Extraction et purification de la protéine FAHD1 du rein de porc et du foie de souris
Summary
Ce protocole décrit comment extraire la protéine 1 contenant le domaine de l’hydrolase fumarylacétoacétate (FAHD1) du rein et du foie de souris. Les méthodes énumérées peuvent être adaptées à d’autres protéines d’intérêt et modifiées pour d’autres tissus.
Abstract
La protéine 1 contenant le domaine de l’hydrolase fumarylacétoacétate (FAHD1) est le premier membre identifié de la superfamille FAH chez les eucaryotes, agissant comme oxaloacétate décarboxylase dans les mitochondries. Cet article présente une série de méthodes pour l’extraction et la purification de FAHD1 à partir de reins de porcs et de foies de souris. Les méthodes couvertes sont la chromatographie par échange ionique avec chromatographie liquide à protéines rapides (FPLC), la filtration sur gel préparatif et analytique avec FPLC et les approches protéomiques. Après l’extraction des protéines totales, la précipitation du sulfate d’ammonium et la chromatographie par échange ionique ont été explorées, et FAHD1 a été extrait via une stratégie séquentielle utilisant la chromatographie par échange ionique et par exclusion de taille. Cette approche représentative peut être adaptée à d’autres protéines d’intérêt (exprimées à des niveaux significatifs) et modifiée pour d’autres tissus. Les protéines purifiées des tissus peuvent favoriser le développement d’anticorps de haute qualité et/ou d’inhibiteurs pharmacologiques puissants et spécifiques.
Introduction
La protéine 1 eucaryote contenant le domaine FAH (FAHD1) agit sous forme d’oxaloacétate bifonctionnel (OAA), decarboxylase (ODx)1 et d’hydrolase acylpyruvate (ApH)2. Il est localisé dans les mitochondries2 et appartient à la vaste superfamille faH des enzymes 1,2,3,4,5,6. Bien que son activité ApH ne soit que d’une pertinence mineure, l’activité ODx de FAHD1 est impliquée dans la régulation du flux de cycle TCA 1,7,8,9. L’OAA est non seulement nécessaire pour la réaction centrale de la citrate synthase dans le cycle de l’acide tricarboxylique, mais agit également comme un inhibiteur compétitif de la succinate déshydrogénase dans le cadre du système de transport d’électrons et comme métabolite cataplérotique. La régulation négative de l’expression du gène FAHD1 dans les cellules endothéliales de la veine ombilicale humaine (HUVEC) a entraîné une réduction significative du taux de prolifération cellulaire10 et une inhibition significative du potentiel de la membrane mitochondriale, associée à un passage concomitant à la glycolyse. Le modèle de travail fait référence à la sénescence associée au dysfonctionnement mitochondrial (MiDAS)phénotype 8 de type MiDAS,11, où les niveaux d’OAA mitochondrial sont étroitement régulés par l’activité FAHD1 1,8,9.
La protéine recombinante est plus facile à obtenir par l’expression et la purification à partir de bactéries12 plutôt que de tissus. Cependant, une protéine exprimée dans les bactéries peut être biaisée par l’absence possible de modifications post-traductionnelles, ou peut simplement être problématique (c.-à-d. en raison de la perte de plasmides, des réponses au stress bactérien, des liaisons disulfures déformées / non formées, de l’absence ou d’une mauvaise sécrétion, de l’agrégation des protéines, du clivage protéolytique, etc.). Pour certaines applications, la protéine doit être obtenue à partir de lysat cellulaire ou de tissu, afin d’inclure de telles modifications et/ou d’exclure d’éventuels artefacts. Les protéines purifiées des tissus favorisent le développement d’anticorps de haute qualité et/ou d’inhibiteurs pharmacologiques puissants et spécifiques pour certaines enzymes, comme pour FAHD113.
Ce manuscrit présente une série de méthodes pour l’extraction et la purification de FAHD1 à partir de reins de porcs et de foies de souris. Les méthodes décrites nécessitent une chromatographie liquide à protéines rapides (FPLC), mais utilisent autrement un équipement de laboratoire commun. D’autres méthodes peuvent être trouvées ailleurs 14,15,16,17. Après l’extraction des protéines totales, le protocole proposé comprend une phase d’essai, au cours de laquelle les sous-protocoles de précipitation du sulfate d’ammonium et de chromatographie par échange ionique sont discutés (figure 1). Après avoir défini ces sous-protocoles, la protéine d’intérêt est extraite via une stratégie séquentielle utilisant l’échange ionique et la chromatographie d’exclusion de taille avec FPLC. Sur la base de ces lignes directrices, le protocole final peut être adapté individuellement à d’autres protéines d’intérêt.
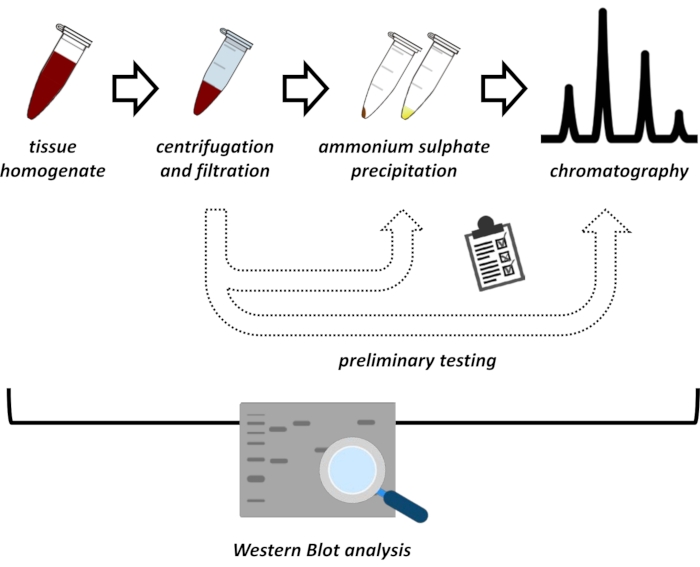
Figure 1 : La stratégie globale de ce protocole. De haut en bas : Les protéines sont extraites des tissus. L’homogénat tissulaire est préparé, centrifugé et filtré. Pour chaque paire d’échantillons surnageants et d’échantillons dérivés de granulés, des tests de précipitation de sulfate d’ammonium et de chromatographie par échange ionique (FPLC) doivent être effectués pour sonder les conditions optimales. Après avoir établi ces sous-protocoles, la protéine peut être extraite par une procédure séquentielle de précipitation du sulfate d’ammonium, de chromatographie par échange ionique et de chromatographie d’exclusion de taille répétitive (FPLC) à des concentrations variables de pH et de sel. Toutes les étapes doivent être contrôlées par transfert western. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Étapes critiques du protocole
Il est essentiel de suivre les directives communes pour la manipulation des protéines, comme le travail sur la glace et à des conditions de pH et de sel modérées. L’utilisation d’inhibiteurs de la protéase est bénéfique pour la méthode, tandis que l’utilisation d’inhibiteurs du protéasome est fortement recommandée. La congélation et la décongélation de l’échantillon peuvent toujours entraîner une précipitation protéique (au moins partielle), de…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs sont très reconnaissants de l’assistance technique d’Ayse Öztürk et Eva Albertini. Les souris utilisées pour la génération de tissu hépatique ont été maintenues sous la supervision de Univ.-Doz. Dr Pidder Jansen-Dürr (Institut de recherche biomédicale sur le vieillissement de l’Université d’Innsbruck, Rennweg 10, 6020 Innsbruck, Autriche).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

