Ekstraksjon og rensing av FAHD1 Protein fra svin nyre og mus lever
Summary
Denne protokollen beskriver hvordan du trekker ut fumarylacetoaceaceacetathydrlase domeneholdig protein 1 (FAHD1) fra svin nyre og mus lever. De oppførte metodene kan tilpasses andre proteiner av interesse og modifiseres for andre vev.
Abstract
Fumarylacetoaceacetathydrlasedomeneholdig protein 1 (FAHD1) er det første identifiserte medlemmet av FAH-superfamilien i eukaryoter, som fungerer som oksaacetatdekarboksylase i mitokondrier. Denne artikkelen presenterer en rekke metoder for utvinning og rensing av FAHD1 fra svin nyre og mus lever. Dekkede metoder er ionisk utvekslingskromatografi med rask proteinvæskekromatografi (FPLC), forberedende og analytisk gelfiltrering med FPLC og proteomiske tilnærminger. Etter total proteinutvinning ble ammoniumsulfatutfelling og ionisk utvekslingskromatografi utforsket, og FAHD1 ble ekstrahert via en sekvensiell strategi ved hjelp av ionisk utveksling og størrelsesekskluderingskromatografi. Denne representative tilnærmingen kan tilpasses andre proteiner av interesse (uttrykt på betydelige nivåer) og modifisert for andre vev. Renset protein fra vev kan støtte utviklingen av antistoffer av høy kvalitet, og/eller potente og spesifikke farmakologiske hemmere.
Introduction
Det eukaryote FAH-domenet som inneholder protein 1 (FAHD1) fungerer som bifunksjonelt oksalacetat (OAA) dekarboksylase (ODx)1 og acylpyruvathydroklase (ApH)2. Den er lokalisert i mitokondrier2 og tilhører den brede FAH superfamilien av enzymer 1,2,3,4,5,6. Mens ApH-aktiviteten bare er av liten relevans, er ODx-aktiviteten til FAHD1 involvert i reguleringen av TCA-syklusfluksen 1,7,8,9. OAA er ikke bare nødvendig for den sentrale sitratsyntasereaksjonen i trikarboksylsyresyklusen, men fungerer også som en konkurransedyktig hemmer av succinat dehydrogenase som en del av elektrontransportsystemet og som en katalakerotisk metabolitt. Nedregulering av FAHD1 genuttrykk i humane navlestrengsvene endotelceller (HUVEC) resulterte i en betydelig reduksjon i frekvensen av celleproliferasjon10, og betydelig hemming av mitokondriemembranpotensial, forbundet med en samtidig bytte til glykolyse. Arbeidsmodellen refererer til mitokondrie dysfunksjon assosiert senescence (MiDAS)11-lignende fenotype8, hvor mitokondrie OAA nivåer er tett regulert av FAHD1 aktivitet 1,8,9.
Rekombinant protein er lettere å oppnå via uttrykk og rensing fra bakterier12 i stedet for fra vev. Imidlertid kan et protein uttrykt i bakterier være partisk av mulig mangel på post-translasjonelle modifikasjoner, eller kan ganske enkelt være problematisk (dvs. på grunn av plasmidtap, bakterielle stressresponser, forvrengte / uformede disulfidbindinger, ingen eller dårlig sekresjon, proteinaggregering, proteolytisk spalting, etc.). For visse bruksområder må protein fås fra cellelys eller vev, for å inkludere slike modifikasjoner og / eller for å utelukke mulige gjenstander. Renset protein fra vev støtter utviklingen av høykvalitets antistoffer, og / eller potente og spesifikke farmakologiske hemmere for utvalgte enzymer, for eksempel for FAHD113.
Dette manuskriptet presenterer en rekke metoder for utvinning og rensing av FAHD1 fra svin nyre og mus lever. De beskrevne metodene krever rask proteinvæskekromatografi (FPLC), men bruker ellers vanlig laboratorieutstyr. Alternative metoder finnes andre steder 14,15,16,17. Etter total proteinutvinning innebærer den foreslåtte protokollen en testfase, der underprotokoller for ammoniumsulfatutfelling og ionisk utvekslingskromatografi diskuteres (figur 1). Etter å ha definert disse underprotokollene, ekstraheres proteinet av interesse via en sekvensiell strategi ved hjelp av ionisk utveksling og størrelsesekskluderingskromatografi med FPLC. Basert på disse retningslinjene kan den endelige protokollen tilpasses individuelt for andre proteiner av interesse.
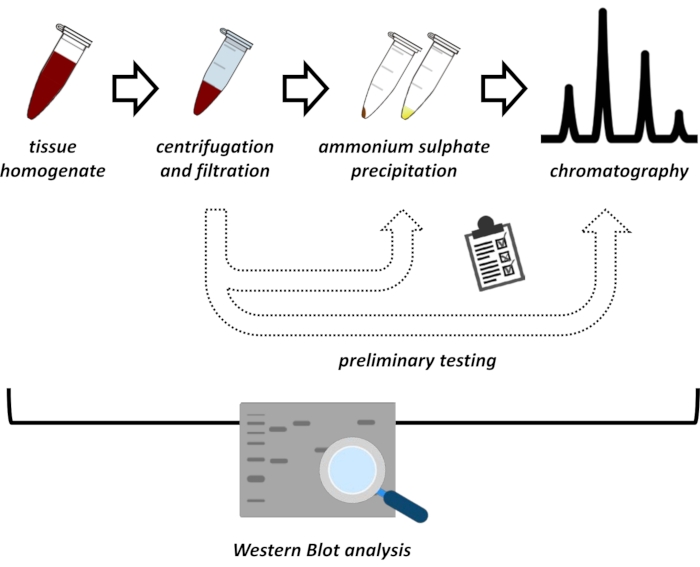
Figur 1: Den overordnede strategien for denne protokollen. Fra topp til bunn: Protein ekstraheres fra vev. Vev homogenat er tilberedt, sentrifugert og filtrated. For hvert par supernatante og pelletsavledede prøver må tester for ammoniumsulfatutfelling og FPLC (onic exchange chromatography) utføres for å sonde for optimale forhold. Etter å ha etablert disse underprotokollene, kan proteinet ekstraheres via en sekvensiell prosedyre for ammoniumsulfatutfelling, ionisk utvekslingskromatografi og repeterende størrelseseksklusjonskromatografi (FPLC) ved varierende pH- og saltkonsentrasjoner. Alle trinn må kontrolleres av vestlig blott. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Kritiske trinn i protokollen
Det er viktig å følge vanlige retningslinjer for håndtering av proteiner, som å jobbe på is og ved moderate pH- og saltforhold. Bruken av proteasehemmere er gunstig for metoden, mens bruk av proteasomhemmere anbefales på det sterkeste. Frysing og opptining av prøven kan alltid resultere i proteinutfelling (i det minste delvis), slik at eventuell tint aliquot av innledende proteinlysat (trinn 2) skal behandles kontinuerlig uten pause. Sentrifugering og filtrering ett…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne er svært takknemlige for den tekniske hjelpen til Ayse Öztürk og Eva Albertini. Mus som brukes til generering av levervev ble opprettholdt under tilsyn av Univ.-Doz. Dr. Pidder Jansen-Dürr (Institutt for biomedisinsk aldringsforskning ved Innsbruck University, Rennweg 10, 6020 Innsbruck, Østerrike).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

