Extraktion och rening av FAHD1-protein från svinnjure och muslever
Summary
Detta protokoll beskriver hur man extraherar fumarylacetoacetathydrolasdomäninnehållande protein 1 (FAHD1) från svinnjure och muslever. De förtecknade metoderna kan anpassas till andra proteiner av intresse och modifieras för andra vävnader.
Abstract
Fumarylacetoacetathydrolasdomäninnehållande protein 1 (FAHD1) är den första identifierade medlemmen av FAH-superfamiljen i eukaryoter, som fungerar som oxaloacetatdekarboxylas i mitokondrier. Denna artikel presenterar en serie metoder för extraktion och rening av FAHD1 från svinnjure och muslever. Omfattade metoder är jonutbyteskromatografi med snabb proteinvätskekromatografi (FPLC), preparativ och analytisk gelfiltrering med FPLC och proteomiska tillvägagångssätt. Efter total proteinutvinning undersöktes ammoniumsulfatutfällning och jonutbyteskromatografi, och FAHD1 extraherades via en sekventiell strategi med jonutbyte och storleksuteslutningskromatografi. Detta representativa tillvägagångssätt kan anpassas till andra proteiner av intresse (uttryckt på signifikanta nivåer) och modifieras för andra vävnader. Renat protein från vävnad kan stödja utvecklingen av högkvalitativa antikroppar och/eller potenta och specifika farmakologiska hämmare.
Introduction
Det eukaryota FAH-domäninnehållande proteinet 1 (FAHD1) fungerar som bifunktionellt oxaloacetat (OAA) dekarboxylas (ODx)1 och acylpyruvathydrolas (ApH)2. Det är lokaliserat i mitokondrier2 och tillhör den breda FAH-superfamiljen av enzymer 1,2,3,4,5,6. Medan dess ApH-aktivitet endast är av mindre relevans, är ODx-aktiviteten hos FAHD1 involverad i regleringen av TCA-cykelflödet 1,7,8,9. OAA krävs inte bara för den centrala citratsyntasreaktionen i trikarboxylsyracykeln utan fungerar också som en konkurrerande hämmare av succinatdehydrogenas som en del av elektrontransportsystemet och som en kataklerotisk metabolit. Nedreglering av FAHD1-genuttryck i humana navelvenendotelceller (HUVEC) resulterade i en signifikant minskning av cellproliferationshastigheten10 och signifikant hämning av mitokondriell membranpotential, associerad med en samtidig övergång till glykolys. Arbetsmodellen avser mitokondriell dysfunktion associerad senescens (MiDAS)11-liknande fenotyp8, där mitokondriella OAA-nivåer regleras hårt av FAHD1-aktivitet 1,8,9.
Rekombinant protein är lättare att få via uttryck och rening från bakterier12 snarare än från vävnad. Ett protein som uttrycks i bakterier kan emellertid vara partiskt av eventuell brist på post-translationella modifieringar, eller kan helt enkelt vara problematiskt (dvs. på grund av plasmidförlust, bakteriella stressreaktioner, förvrängda / oformade disulfidbindningar, ingen eller dålig utsöndring, proteinaggregering, proteolytisk klyvning etc.). För vissa tillämpningar måste protein erhållas från celllysat eller vävnad för att inkludera sådana modifieringar och/eller utesluta eventuella artefakter. Renat protein från vävnad stödjer utvecklingen av högkvalitativa antikroppar och/eller potenta och specifika farmakologiska hämmare för utvalda enzymer, såsom för FAHD113.
Detta manuskript presenterar en serie metoder för extraktion och rening av FAHD1 från svinnjure och muslever. De beskrivna metoderna kräver snabb proteinvätskekromatografi (FPLC) men använder i övrigt vanlig laboratorieutrustning. Alternativa metoder kan hittas någon annanstans 14,15,16,17. Efter total proteinextraktion innefattar det föreslagna protokollet en testfas, där underprotokoll för ammoniumsulfatutfällning och jonutbyteskromatografi diskuteras (Figur 1). Efter att ha definierat dessa underprotokoll extraheras proteinet av intresse via en sekventiell strategi med hjälp av jonutbyte och storleksuteslutningskromatografi med FPLC. Baserat på dessa riktlinjer kan det slutliga protokollet anpassas individuellt för andra proteiner av intresse.
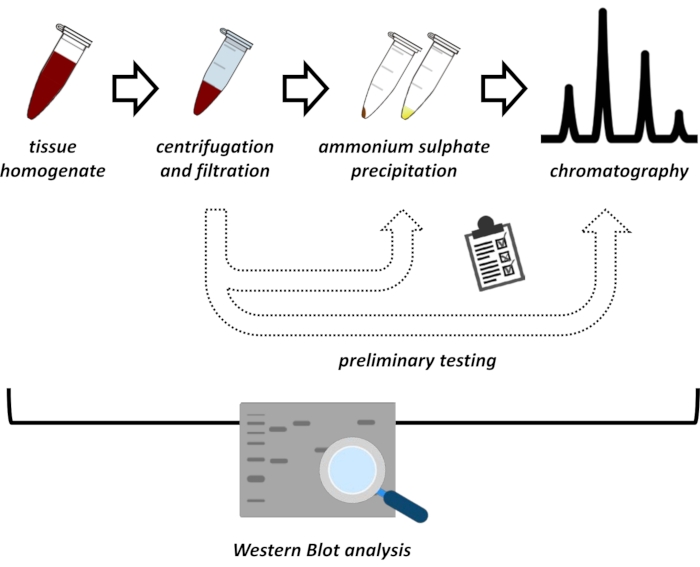
Figur 1: Den övergripande strategin för detta protokoll. Från topp till botten: Protein extraheras från vävnader. Vävnadshomogenat framställs, centrifugeras och filtreras. För varje par supernatanta och pellet-härledda prover, tester för ammoniumsulfat utfällning och jonisk utbyte kromatografi (FPLC) måste utföras för att sondera för optimala förhållanden. Efter upprättandet av dessa underprotokoll kan proteinet extraheras via ett sekventiellt förfarande för ammoniumsulfatutfällning, jonbyteskromatografi och repetitiv storleksuteslutningskromatografi (FPLC) vid varierande pH- och saltkoncentrationer. Alla steg måste kontrolleras av western blot. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Kritiska steg i protokollet
Att följa gemensamma riktlinjer för hantering av proteiner är viktigt, till exempel att arbeta på is och vid måttliga pH- och saltförhållanden. Användningen av proteashämmare är fördelaktig för metoden, medan användningen av proteasomhämmare rekommenderas starkt. Frysning och upptining av provet kan alltid leda till proteinutfällning (åtminstone delvis), så all upptinad alikvot av initialt proteinlysat (steg 2) bör bearbetas kontinuerligt utan avbrott. Cen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Författarna är mycket tacksamma för den tekniska hjälpen av Ayse Öztürk och Eva Albertini. Möss som användes för generering av levervävnad upprätthölls under överinseende av Univ.-Doz. Dr. Pidder Jansen-Dürr (Institutet för biomedicinsk åldrandeforskning vid Innsbruck universitet, Rennweg 10, 6020 Innsbruck, Österrike).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

