מערכת מיקרופיזיולוגית של הכבד האנושי להערכת רעילות כבד הנגרמת על ידי תרופות במבחנה
Summary
פגיעה בכבד הנגרמת על-ידי תרופות (DILI) היא הגורם העיקרי לכשל תרופתי. פותח פרוטוקול לחיזוי מדויק של אחריות DILI של תרכובת באמצעות מערכת מיקרופיזיולוגית של הכבד (MPS). מודל הכבד משתמש בקוקולטורה של תאי כבד ראשוניים ובנקודות קצה רלוונטיות לתרגום כדי להעריך את תגובות התאים לטיפול.
Abstract
DILI היא גורם מרכזי להתשה בפיתוח תרופות עם למעלה מ-1,000 תרופות שאושרו על ידי ה-FDA וידועות כגורמות ל-DILI בבני אדם. למרבה הצער, DILI לעתים קרובות אינו מזוהה עד שהתרופות מגיעות לשלבים קליניים, מה שמסכן את בטיחות המטופלים ומוביל להפסדים משמעותיים לתעשיית הפארמה. אם ניקח בחשבון שלמודלים דו-ממדיים סטנדרטיים יש מגבלות בזיהוי DILI, חיוני לפתח מודלים במבחנה שהם חזויים יותר כדי לשפר את יכולת תרגום הנתונים. כדי להבין בפירוט את הסיבתיות ואת ההיבטים המכניסטיים של DILI, פותח MPS של כבד אנושי המורכב מתאים פרנכימליים ראשוניים של הכבד האנושי ותאים שאינם פרנכימליים (NPCs) ומתורבתים במיקרו-רקמות תלת-ממדיות על פיגום מהונדס תחת זלוף. תאי הפטוציטים האנושיים הראשוניים (PHHs) ותאי קופפר (HKCs) גודלו כמיקרו-רקמות בפלטפורמת MPS במשך עד שבועיים, וכל תרכובת מעניינת הוכנסה שוב ושוב למיקרו-רקמות של הכבד בשבעה ריכוזי בדיקה למשך עד ארבעה ימים. נותחו נקודות קצה פונקציונליות ספציפיות לכבד (כולל סמנים ביולוגיים קליניים כגון אלנין אמינוטרנספראז, ALT) כדי להעריך את תפקוד הכבד. ניתן להעריך חשיפה חריפה וכרונית לתרכובות בדרגות חומרה שונות של DILI על ידי השוואת תגובות למיקרו-רקמות בודדות ורב-מינונים. המתודולוגיה אומתה עם קבוצה רחבה של תרכובות הפטוטוקסיות חמורות קלות. כאן אנו מראים את הנתונים עבור pioglitazone ו troglitazone, תרכובות hepatotoxic ידוע נסוג מהשוק על גרימת כשלים בכבד. באופן כללי, הוכח כי מודל MPS בכבד יכול להיות כלי שימושי להערכת DILI והקשר שלו לשינויים בתפקוד הכבד. המודל יכול לשמש גם כדי להעריך כיצד תרכובות חדשניות מתנהגות בתת-קבוצות נפרדות של מטופלים וכיצד פרופילי רעילות עשויים להיות מושפעים ממצבי מחלות כבד (למשל, הפטיטיס נגיפית, מחלת כבד שומני).
Introduction
DILI נותרה הסיבה השכיחה ביותר לאי ספיקת כבד חריפה בארה”ב ובאירופה והיא גורם מוביל להתשה של תרכובות בתהליך פיתוח התרופה1. כמעט כל סוגי התרופות יכולים לגרום להפטוטוקסיות, כאשר סוכני מערכת העצבים המרכזית ואנטיביוטיקה הם ללא ספק הטיפולים הנפוצים ביותר הגורמים ל- DILI בחולים2. הפטוטוקסיות הנגרמות על ידי תרופות נגרמת על ידי אינטראקציה מורכבת של גורמים גנטיים, לא גנטיים וסביבתיים, מה שמוביל למוות של הפטוציטים וסוגי תאי כבד אחרים, כולל כולנגיוציטים ותאי אנדותל 1,3.
ניתן לסווג את הגורמים הגורמים ל-DILI בשתי דרכים: אלה הגורמים לנזק כבד תלוי מינון צפוי או אלה הגורמים ל- DILI אידיוסינקרטי שהוא נדיר ומתפתח ללא תלות במינון תרופה, או מסלול, או משך מתן תרופה, אך אחראי עד שישית מכל כשלי הכבד החריפים בארה”ב רק4. למרבה הצער, DILI הוא לעתים קרובות לא מזוהה עד תרופות הגיעו לשלבים הקליניים של תהליך פיתוח התרופה. דירוג פגיעה בכבד הנגרמת על ידי תרופות (או DILIrank) מורכב מיותר מאלף תרופות שאושרו על ידי ה- FDA המחולקות לארבעה סוגים בהתאם לפוטנציאל שלהן לגרום ל- DILI, ויש לעקוב מקרוב אחר השימוש בהן בחולים5.
חקר מנגנונים של הפטוטוקסיות של תרופות נותר מאתגר מאוד, ולכן פותחו מודלים פרה-קליניים רבים כדי לחקור מנגנונים של DILI. למודלים הנוכחיים במבחנה וב-in vivo המשמשים לחיזוי DILI בפיתוח פרה-קליני יש מספר מגבלות למתן תובנות על האינטראקציות המורכבות ומרובות הפנים בגוף אדם חי. קווי תאי כבד סרטניים (כלומר, HepG2, HepaRG) בתרבית בדו-ממד עדיין משמשים בשלבים המוקדמים של פיתוח תרופות להערכת הרעילות של תרכובות מועמדות6. עם זאת, קווי תאים אלה מגיעים מתורמים בודדים ומראים רמות חריגות של תפקוד הכבד, ולא תמיד מפגינים רגישות גבוהה לגילוי DILI 7,8. כחלופה לקווי תאי כבד סרטניים, PHHs מייצגים טוב יותר את הפיזיולוגיה של הכבד האנושי אם הם מתרבים כראוי במבחנה, אם כי קיימות מספר מגבלות עם התרבית שלהם, כמו זמן דגירה קצר עם תרופות, אורך חיים קצר יחסית, אובדן ביטוי גנים בכבד ושינויים בתפקודים מטבוליים של תרופות 9,10,11 . PHHs יכולים להיות בתרבית על חלבוני מטריצה חוץ-תאית בלוחות תרבית תאים דו-ממדיים סטנדרטיים, אך כחיסרון, הירידה המהירה בתפקודם פירושה שיש להם רגישות נמוכה (<50%) לחיזוי DILI12.
מצד שני, ניסויים במודלים של בעלי חיים הם איטיים, יקרים, וזקוקים לתרגום חוצה מינים כדי לבצע אקסטרפולציה של חיזוי לבני אדם. רוב התרופות שפותחו לאחרונה אינן מצליחות לקבל אישור מה שהופך את התהליך הזה ליקר ומסוכן5. יתר על כן, לבדיקת שיטות חדשות ספציפיות לבני אדם, מודלים של בעלי חיים פחות מתאימים בגלל הבדלים ברצף הגנים או בתגובה החיסונית לעומת בני אדם13.
כתוצאה מכך, העניין במודלים מתקדמים יותר של כבד תלת-ממדי (3D) במבחנה גדל באופן אקספוננציאלי. גידול PHHs כמבנים כדוריים הנוצרים על ידי צבירה כבידתית בטיפות תלויות או על משטחי חיבור אולטרה-נמוכים מייצג שיטה בעלת תפוקה גבוהה להערכת התחייבויות מורכבות14. ספרואידים PHH שימשו להערכת DILI ברקע חולה (למשל, סטאטוזיס וכולסטזיס)15. מגוון רחב של מודלים פותחו כדי לכלול מצופה מיקרו-דפוס cocultures של hepatocytes עם פיברובלסטים סטרומליים16, רקמות כבד מודפסות ביו 3D 17, תרביות ספרואידים 3D עם או בלי תאים שאינם פרנכימליים בכבד15. עם זאת, לכל השיטות הללו עדיין יש חסרונות, וגידול PHHs במיקרו-סביבה רלוונטית יותר מבחינה פיזיולוגית יכול לספק להם רמות גבוהות יותר של פונקציונליות לפרקי זמן ממושכים כדי לאפשר חקירה של חשיפה ממושכת להפטוטוקסיקנים פוטנציאליים. בנוסף, כדי לשפר את הרלוונטיות התרגומית של כל תרבית PHH מתקדמת במבחנה, יש להשתמש בנקודות קצה פונקציונליות רלוונטיות מבחינה קלינית או בסמנים ביולוגיים של תפוקת רעילות כדי לאפשר השוואה בין נתונים in vivo או תרחישים קליניים18.
במחקר זה הערכנו אם ניתן להשתמש במודל כבד במבחנה, הידוע גם בשם איבר-על-שבב (OOC), כדי להבין את ההיבטים המכניסטיים המפורטים של רעילות כבד. בעבר הוכח כי ה-MPS שומר על מיקרו-רקמות כבד תלת-ממדיות מתפקדות מאוד, תחת זרימה, למשך עד 4 שבועות19. המערכת נבדקה לאחרונה על ידי ה-FDA והוכחה כבעלת יכולת שכפול גבוהה בעת ביצוע רעילות לתרופות, חילוף חומרים והצטברות תוך תאית20. יתר על כן, בהשוואה לספרואידים ותרביות סנדוויץ ‘, למערכת היה תפקיד יציב יותר ורגישות גבוהה יותר באיתור הרעילות של מספר תרופות20. עד כה, ה-MPS שימש במגוון רחב של יישומים המכסים ADME 21, מידול מחלות (HBV 22, NAFLD 23,24,25) ואינטראקציות בין תרופות 26, מה שעשוי להפוך אותו למתאים מאוד להערכת DILI אקוטי וכרוני. הטכנולוגיה המוצגת כאן מציעה אלטרנטיבה לסגירת הפער בין תרביות תאים מסורתיות יותר ומודלים של בעלי חיים לבין ניסויים קליניים בבני אדם, ומתקדמת לקראת סימולציה של תנאים ביולוגיים אנושיים כדי לתמוך בהערכת רעילות הכבד של תרכובות מועמדות בשלבים פרה-קליניים של תהליך פיתוח התרופה.
Protocol
Representative Results
Discussion
MPS נועדו לשחזר יחידות פונקציונליות של איברים אנושיים במבחנה ופותחו כדי לענות על המגבלות של מודלים קונבנציונליים של תרביות תאים תלת-ממדיות27. הכבד הוא אחד האיברים המעוצבים ביותר באמצעות MPS, ומגוון רחב של מערכות פותחו. הכבד האנושי אחראי על חילוף החומרים של תרופות ועל יצירת מטבוליטים רעילים של תרופות, ותפקודו הוא מרכיב מפתח במודל לפיתוח תרופות, כולל הערכת אחריות DILI של תרכובות28. כאן הצגנו שיטה חדשה להערכת DILI באמצעות MPS כבד; הפרוטוקול מאפשר לחפש תובנות מכניסטיות עבור כל תרכובת שנבדקת כדי לקבוע כיצד היא עלולה לגרום ל-DILI, כמו גם להיות בדיקה רגישה וחזקה ביותר. מיקרו-רקמות כבד נוצרות בלוחות MPS, שהם קולקולטורה של PHH ו- HKCs והם פונקציונליים מאוד עם רמות גבוהות של ייצור אלבומין ואוריאה, כמו גם פעילות CYP3A4 גבוהה בהשוואה לדגמי כבד סטנדרטיים במבחנה 20.
למרות שמודל DILI המתואר כאן יכול לשמש ככלי שימושי בשלבים מאוחרים יותר של בדיקות פרה-קליניות בתהליך פיתוח התרופה, יש לו גם מספר מגבלות. מכיוון שרוב שירותי ה-MPS הזמינים כיום בשוק, זוהי פלטפורמה בעלת תפוקה נמוכה, ולכן קשה יותר להשתמש בה לפעילויות סינון סמים בקנה מידה גדול. מודל DILI, המורכב ממיקרו-רקמות שנוצרו על ידי PHHs ו-HKCs מתכלים, גם אינו יכול ללכוד לחלוטין את המורכבות של הכבד האנושי, ואופטימיזציה נוספת על ידי שילוב סוגים שונים של תאים (למשל, תאי מערכת החיסון) תועיל כדי להוסיף ערך למודל הקיים. ניתן לשלב את ה-MPS החד-איברי הזה גם עם פלטפורמות איברים אחרות שיכולות לחלוק מדיום משותף ולאפשר הצלבת איברים ברמה התאית או האנדוקרינית, וזה יכול לעזור להבין טוב יותר את התובנות המכניסטיות של רעילות שאינה מוגבלת רק לכבד עצמו. יתר על כן, כמו כל טכנולוגיה חדשה יחסית, היא עשויה להיחשב יקרה ולכן בעלת נגישות מוגבלת.
MPS היא פלטפורמה המשמשת לפיתוח מודלים אורגנוטיפיים של רקמות חד-אנושיות או רב-אנושיות. המערכת מורכבת מבקר, כבל טבור ומנהל התקן MPS שלתוכו מוכנסת הצלחת (איור 5A). בכל צלחת MPS לכבד יש 12 בארות פתוחות עצמאיות לגידול תאי כבד ראשוניים בתלת-ממד על פיגומים מהונדסים. לסיכום, המערכת נבדקת QC, והצלחות מוכנות ביום -1, ה-PHHs וה-HKCs נזרעים על הצלחות ביום אפס (איור 5B, ראו 1). מיקרו-משאבות משובצות מאפשרות את זרימת המדיה של תרביות תאים דרך הפיגומים כדי להקל על היווצרותם של מיקרו-רקמות תלת-ממדיות (איור 5B, ראו 2). מיקרו-רקמות שנוצרו הן QC’d ביום 4, מינון עם ריכוזים שונים של כל תרכובת כל 48 שעות במשך 4 ימים, ונבדק עבור סמנים ביולוגיים של נקודות קצה ביום 8 (איור 5C). ציר הזמן הניסיוני של בדיקת DILI בלוח MPS מתואר באיור 5D.
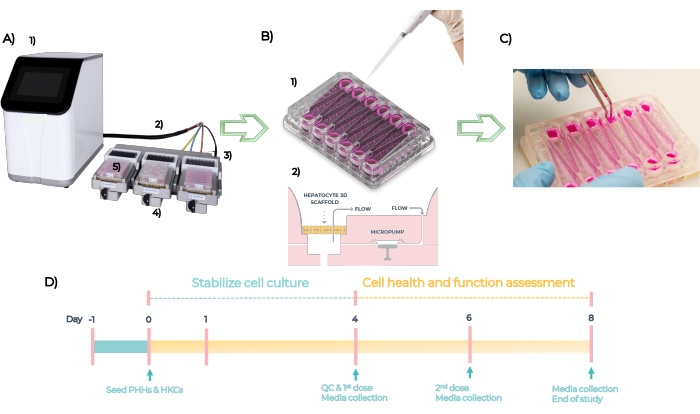
איור 5: המערכת המיקרופיזיולוגית וציר הזמן הניסויי של בדיקת DILI סטנדרטית. (A) המערכת המיקרופיזיולוגית על מרכיביה: בקר (1), כבל טבור (2), תחנת עגינה (3), מנהל התקן MPS (4) ולוח LC12 (5). (B) זריעה של PHHs ו- HKCs על צלחת LC12 ביום 1 (1) ומיקרו-משאבות מוטבעות מקלות על זרימת מדיה של תרבית תאים עם קצבי זרימה הניתנים לכוונון דרך המיקרו-רקמות התלת-ממדיות שנזרעו על הפיגומים (2). (C) הורדת הפיגומים בסוף המחקר. (D) ציר הזמן הניסויי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
בעת ביצוע הפרוטוקול, חשוב שתבוצע בדיקת QC חזקה של המערכת לפני שתתחיל, תבדוק שהמערכת מתפקדת כראוי מבחינה פניאומטית והלוחות המתכלים נבדקים חזותית ומוכנים ביעילות כדי להבטיח פונקציונליות אחידה בכל הבארות. תאים אנושיים ראשוניים באיכות גבוהה חיוניים לפרוטוקול זה, כאשר הפטוציטים ידועים כדבקים באופן עקבי בניסויים בתרביות תאים ויוצרים אינטראקציות תלת-ממדיות. הפשרת תאים אלה היא גם שלב קריטי, שכן אין להחיות את ההפטוציטים הראשוניים על ידי פעולת פיפטינג מכיוון שהדבר עלול להוביל במהירות למוות של תאים. קיום תאים מעל 85% הוא קריטי לזריעה מוצלחת, שכן כמויות גדולות של פסולת תאית יפריעו להיווצרות מיקרו-רקמה תלת-ממדית. בדיקת QC של מיקרו-רקמות כבד שנוצרו ביום 4 חשובה גם היא, והמשתמש צריך לוודא שרמות מקובלות של LDH ו- Urea נמדדות, מכיוון שפרמטרים מחוץ לטווח עשויים להעיד על היווצרות רקמות באיכות ירודה ולאפשר פתרון בעיות פשוט. לבסוף, ההידרוקורטיזון המשמש במדיה של תרבית התאים חייב להיות מוכן טרי ביום השימוש כדי למנוע כל השפלה לא רצויה שעלולה להשפיע על תפקוד תרבית התא, כפי שהוא נדרש כדי לשמור על פונקציונליות מטבולית של hepatocytes.
למרות היותו בעל מורכבות משמעותית, MPS הכבד אינו מכיל את כל סוגי התאים של הכבד האנושי. ניתן להוסיף סוגי תאים נוספים למודל24,29 כדי להגדיל את הרלוונטיות הפיזיולוגית, אך יש להוסיף אותם רק עם הצדקה ברורה להקשר השימוש. לחקר DILI PHH הם סוג תא המפתח, והשילוב של HKCs במודל זה מאפשר לקבוע כמה תגובות אימונולוגיות. כמו כן, יש לציין כי PHHs מבודדים מכבדים אנושיים ו- PHHs בהקפאה הזמינים מסחרית נוטים להדגים כמה וריאציות מלוט ללוט. הוכחנו כאן כי פרוטוקול זה מייצר תוצאות הניתנות לשחזור כאשר משתמשים בו עם תכשירים איכותיים של תאים. עם זאת, ניתן היה לצפות לשונות מסוימת של לוט-לוט, וניתן להתגבר על כך עוד יותר על ידי שימוש במאגר של תורמים מרובים. ניתן להתגבר על מגבלות אלה על ידי שימוש בתאים דמויי הפטוציטים המתמיינים מ- iPSC המסכמים תכונות תפקודיות רבות של PHHs ואשר שימשו בתהליך פיתוח התרופה30. HKCs גם מראים הרבה השתנות רבה ורמה גבוהה של הפעלה עם הפשרה; לכן, תורמי HKCs מאומתים מראש בתוך החברה לפני השימוש בתרבית תאים ניסיונית (coculture עם PHHs מאומתים) וחייבים להיות בעלי רמות נמוכות של הפעלה לאחר הפשרה; זה מוערך על ידי מדידת סמנים ביולוגיים IL-6 ו- TNF-אלפא (ראה חומר משלים).
הנתונים המוצגים כאן מאשרים כי הבדיקה יכולה לזהות DILI במדויק, ומסייעת בזיהוי הפטוטוקסינים שאולי לא יזוהו על ידי2D 10,11 ואפילו כמה מודלים תלת-ממדיים. נתונים המופקים מ- MPS עדיין אינם משמשים כתקן על ידי תעשיית התרופות לצורך הגשות רגולטוריות או בדיקות סקר תרופות בשל היעדר סטנדרטיזציה והרמוניזציה של תהליכים, כולל שכפול בין-אתרי20. הנתונים והגישות הניסוייות שהודגמו כאן מתייחסים לכך, ומראים כי ניתן להשתמש במודל הכבד באופן שגרתי וחזק במסכי DILI כדי לחזות במדויק את האחריות של תרכובות חדשות.
על ידי מדידת מגוון של נקודות קצה כדי לייצר “חתימה של hepatotoxicity”, עוזר לזהות תרכובות עם רמות שונות של דאגה DILI (כולל תרכובות שאינן ניתנות לזיהוי על ידי שיטות אחרות במבחנה) ואת מנגנוני הרעילות שלהם נחשף. טכנולוגיה זו יכולה לסגור את הפער בין תרבית תאים מסורתית ומודלים של בעלי חיים מצד אחד לבין ניסויים קליניים בבני אדם, ולהתקדם לקראת סימולציה של תנאים ביולוגיים אנושיים לצורך הערכה פרה-קלינית של רעילות הכבד כחלק מתהליך פיתוח התרופה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
CN Bio Innovations Ltd. מימנה מחקר זה.
Materials
| 24 well cell culture cluster plates flat bottom | Corning | 3524 | |
| 96 well clear assay plates, flat bottom clear plastic | Greiner | 655101 | |
| 96 well plates black flat bottom | Corning | 3915 | |
| 96 Well White/Clear Bottom Plate, TC Surface | ThermoScientific | 165306 | |
| Advanced DMEM (1x) | Gibco | 12491015 | Cell culture media. |
| AssayMax Albumin ELISA Kit | AssayPro | EA3201-1 | Dilution 1:250. Time point Day 4, 6, and 8. |
| Cell Maintenance Cocktail B, (Primary Hepatocyte Maintenance Supplements) | Gibco | CM4000 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | Dilution 1:1. Time point Day 8. |
| Chlorpromazine HCl | Sigma Aldrich | C8138 | |
| Chromacol blue lids, 9 mm Autosampler Vial Screw Thread Caps | ThermoScientific | 9-SCK(B)-ST1 | glass vial |
| Chromacol vials, 9 mm Clear Glass Screw Thread Vials | ThermoScientific | 2-SVW | |
| Class 2 Microbiological Safety Cabinets – Trimat2 1500 exhaust | Contained Air Solutions | ||
| Conical tubes 50 mL | Greiner | 227261 | |
| Cryopreserved Hepatocyte Recovery Medium (CHRM) | ThermoFisher Scientific | Gibco CM7000 | |
| Cryopreserved primary human hepatocytes | BioIVT Europe | Lot. RAS | |
| CytoTox 96 Cytotoxicty (LDH) Assay Kit | Promega | G1781 | Dilution – none. Time point Day 4, 6 and 8 |
| >Data analysis model used to generate the graph and EC:50 curves was nonlinear regression (curve fit) asymmetric sigmoidal, 5PL, where X is log(concentration | GraphPad Prism 9 | ||
| Disposable PES Filter Units 500mL | Fisher Scientific | 15913307 | |
| Disposable Pipette Basins 50ml | Fisher Scientific | 12369175 | |
| DMSO (Dimethyl sulfoxide) | Sigma-Aldrich | Sigma D2650 | |
| Dulbeco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | ThermoFisher Scientific | 14190-144 | |
| Easy Reader Conical Polypropylene Centrifuge Tubes 15 mL | Fisher Scientific | 11889640 | |
| Foetal bovine serum | Gibco | 10500064 | |
| Human ALT ELISA Kit | Abcam | ab 234578 | Dilution 1:5. Time point Day 6 and 8. |
| Human Cryopreserved Kupffer Cells | Lonza Europe | Lot. 190088KC | |
| hydrocortisone | Merck | H0888-1G | |
| Incubators models: New Brunswick Galaxy 170 S, New Brunswick Galaxy 170 R and CellXpert® C170. | Eppendorf | All serviced yearly; paperwork available upon request. | |
| Inverted Microscope | Leica DMIL LED | ||
| MPS know as Organ-on-a-Chip (OOC) | CN Bio Innovations Ltd. | ||
| MPS LC-12 plate | CN Bio Innovations Ltd. | ||
| Neubauer Improved C-Chip Disposable Haemocytometer (2 channel) | Cambridge Bioscience | DHC-N01-50 | |
| P450-Glo CYP3A4 Assay and Screening System | Promega | V9002 | Dilution – none. Time point Day 8 |
| PhysioMimix MPS platform | CN Bio Innovations Ltd. | ||
| Pioglitazone | MedChemExpress Tocris | HY-13956/CS-1700 | |
| Quantichrom Urea Assay Kit – Bioassay systems | Bioassay Systems | DY970-05 | Dilution 1:2 if initial reading is too high. Time point Day 4, 6 and 8. |
| Silica gel | Sigma-Aldrich | S7625 | |
| Software used to analyse and generate all the graphs was | GraphPad Prism 9 | ||
| Stripettes 10 mL | Fisher Scientific | 11839660 | |
| Stripettes 25 mL | Fisher Scientific | 11839181 | |
| Thawing plate Cocktail A, (Primary Hepatocyte Thawing and Plating Supplements) | Gibco | CM3000 | |
| Troglitazone | MedChemExpress Tocris | 97322-87-7 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Tubes 1.5 mL | Greiner | 616201 | |
| Weighing balance – model PA214C and AV213C | Ohaus Corp |
References
- Lisi, D. M. Drug-induced liver injury: An overview. US Pharmacist. 41 (12), 30-34 (2016).
- Kuna, L., et al. Models of drug induced liver injury (DILI)-current issues and future perspectives. Current Drug Metabolism. 19 (10), 830-838 (2018).
- Katarey, D., Verma, S. Drug-induced liver injury. Clinical Medicine. 16 (6), 104-109 (2016).
- Kullak-Ublick, G. A., et al. Drug-induced liver injury: recent advances in diagnosis and risk assessment Recent advances in clinical practice. Gut. 66, 1154-1164 (2017).
- Dirven, H., et al. Performance of pre-clinical models in predicting drug-induced liver injury in humans: a systematic review. Scientific Reports. 11 (1), 6403 (2021).
- Donato, M. T., Lahoz, A., Castell, J. V., Gomez-Lechon, M. J. Cell lines: a tool for in vitro drug metabolism studies. Current Drug Metabolism. 9 (1), 1-11 (2008).
- Wilkening, S., Stahl, F., Bader, A. Comparison of primary human hepatocytes and hepatoma cell line HepG2 with regard to their biotransformation properties. Drug Metabolism and Disposition. 31 (8), 1035-1042 (2003).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28 (2), 69-87 (2012).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical Research. 23 (7), 1482-1490 (2006).
- Li, F., Cao, L., Parikh, S., Zuo, R. Three-dimensional spheroids with primary human liver cells and differential roles of kupffer cells in drug-induced liver injury. Journal of Pharmaceutical Sciences. 109 (6), 1912-1923 (2020).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Lin, C., Khetani, S. R. Advances in engineered liver models for investigating drug-induced liver injury. BioMed Research International. 2016, 1829148 (2016).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regulatory Toxicology and Pharmacology. 32 (1), 56-67 (2000).
- Bell, C. C., et al. Comparison of hepatic 2D sandwich cultures and 3D spheroids for long-term toxicity applications: A multicenter study. Toxicological Sciences. 162 (2), 655-666 (2018).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Khetani, S. R., et al. Use of micropatterned co-cultures to detect compounds that cause drug-induced liver injury in humans. Toxicological Sciences. 132 (1), 107-117 (2013).
- Ma, X., et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proceedings of the National Academy of Sciences of the united States of America. 113 (8), 2206-2211 (2016).
- Dieterle, P. Y. M., Dieterle, F. Tissue-specific, non-invasive toxicity biomarkers: translation from pre-clinical safety assessment to clinical safety monitoring. Expert Opinion on Drug Metabolism & Toxicology. 5 (9), 1023-1038 (2009).
- Rowe, C., et al. Perfused human hepatocyte microtissues identify reactive metabolite-forming and mitochondria-perturbing hepatotoxins. Toxicology in Vitro. 46, 29-38 (2018).
- Rubiano, A., et al. Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation. Clinical and Translational Science. 14 (3), 1049-1061 (2021).
- Tsamandouras, N., Kostrzewski, T., Stokes, C. L., Griffith, L. G., Hughes, D. J., Cirit, M. Quantitative assessment of population variability in hepatic drug metabolism using a perfused three-dimensional human liver microphysiological system. Journal of Pharmacology and Experimental Therapeutics. 360 (1), 95-105 (2017).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological pre-clinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Kostrzewski, T., et al. Three-dimensional perfused human in vitro model of non-alcoholic fatty liver disease. World Journal of Gastroenterology. 23 (2), 204-215 (2017).
- Kostrzewski, T., et al. A microphysiological system for studying nonalcoholic steatohepatitis. Hepatology Communications. 4 (1), 77-91 (2020).
- Vacca, M., et al. Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis. Nature Metabolism. 2 (6), 514-531 (2020).
- Long, T. J., et al. Modeling therapeutic antibody-small molecule drug-drug interactions using a three-dimensional perfusable human liver co-culture platforms. Drug Metabolism and Disposition. 44, 1940-1948 (2016).
- Bai, J., Wang, C. Organoids and microphysiological systems: New tools for ophthalmic drug discovery. Frontiers in Pharmacology. 11, 407 (2020).
- Ribeiro, A. J. S., Yang, X., Patel, V., Madabushi, R., Strauss, D. G. Liver microphysiological systems for predicting and evaluating drug effects. Clinical Pharmacology & Therapeutics. 106 (1), 139-147 (2019).
- Clark, A. M., et al. A microphysiological system model of therapy for liver micrometastases hhs public access. Experimental Biology and Medicine (Maywood). 239 (9), 1170-1179 (2014).
- Qosa, H., Ribeiro, A. J. S., Hartman, N. R., Volpe, D. A. Characterization of a commercially available line of iPSC hepatocytes as models of hepatocyte function and toxicity for regulatory purposes. Journal of Pharmacological and Toxicological Methods. 110, 107083 (2021).

