İlaca Bağlı Karaciğer Toksisitesini In Vitro Olarak Değerlendirmek için İnsan Karaciğer Mikrofizyolojik Sistemi
Summary
İlaca bağlı karaciğer hasarı (DILI) ilaç yetmezliğinin önemli bir nedenidir. Bir karaciğer mikrofizyolojik sistemi (MPS) kullanarak bir bileşiğin DILI sorumluluğunu doğru bir şekilde tahmin etmek için bir protokol geliştirilmiştir. Karaciğer modeli, tedaviye hücresel yanıtları değerlendirmek için primer hepatik hücrelerin kokültürüne ve translasyonel olarak ilgili son noktalara sahiptir.
Abstract
DILI, insanlarda potansiyel olarak DILI’ye neden olduğu bilinen 1000’den fazla FDA onaylı ilaçla ilaç geliştirmede yıpranmanın önemli bir nedenidir. Ne yazık ki, DILI genellikle ilaçlar klinik aşamalara ulaşana kadar tespit edilmez, bu da hastaların güvenliğini riske atar ve ilaç endüstrisi için önemli kayıplara yol açar. Standart 2D modellerin DILI’yi algılamada sınırlamaları olduğu göz önüne alındığında, veri çevrilebilirliğini artırmak için daha öngörücü olan in vitro modeller geliştirmek esastır. DILI’nin nedenselliğini ve mekanik yönlerini ayrıntılı olarak anlamak için, insan birincil karaciğer parankimal ve parankimal olmayan hücrelerden (NPC’ler) oluşan ve perfüzyon altında tasarlanmış bir iskele üzerinde 3D mikrodokularda kültürlenmiş bir insan karaciğer MPS’si geliştirilmiştir. Kriyokorunmuş birincil insan hepatositleri (PHH’ler) ve Kupffer hücreleri (HKC’ler), MPS platformunda iki haftaya kadar mikrodokular olarak birlikte kültürlendi ve ilgilenilen her bileşik, dört güne kadar yedi test konsantrasyonunda karaciğer mikrodokularına tekrar tekrar dozlandı. Karaciğer fonksiyonunu değerlendirmek için fonksiyonel karaciğere özgü sonlanım noktaları (alanin aminotransferaz, ALT gibi klinik biyobelirteçler dahil) analiz edildi. Çeşitli DILI şiddetindeki bileşiklere akut ve kronik maruziyet, tek ve çok dozlu mikrodokulara verilen yanıtları karşılaştırarak değerlendirilebilir. Metodoloji, çok çeşitli şiddetli ve hafif hepatotoksik bileşiklerle doğrulanmıştır. Burada, karaciğer yetmezliğine neden olduğu için piyasadan çekilen iyi bilinen hepatotoksik bileşikler olan pioglitazon ve troglitazon için verileri gösteriyoruz. Genel olarak, karaciğer MPS modelinin DILI’yi ve hepatik fonksiyondaki değişikliklerle ilişkisini değerlendirmek için yararlı bir araç olabileceği gösterilmiştir. Model ayrıca, yeni bileşiklerin farklı hasta alt kümelerinde nasıl davrandığını ve toksisite profillerinin karaciğer hastalığı durumlarından (örneğin, viral hepatit, yağlı karaciğer hastalığı) nasıl etkilenebileceğini değerlendirmek için kullanılabilir.
Introduction
DILI, ABD ve Avrupa’da akut karaciğer yetmezliğinin en yaygın nedeni olmaya devam etmektedir ve ilaç geliştirme sürecinde bileşiklerin yıpranmasının önde gelen bir nedenidir1. Neredeyse tüm ilaç sınıfları hepatotoksisiteye neden olabilir, merkezi sinir sistemi ajanları ve antibiyotikler hastalarda DILI’ye neden olan en yaygın tedavilerdir2. İlaca bağlı hepatotoksisite, genetik, genetik olmayan ve çevresel faktörlerin karmaşık bir etkileşiminden kaynaklanır ve hepatositlerin ve kolanjiyositler ve endotel hücreleri de dahil olmak üzere diğer karaciğer hücre tiplerinin ölümüne yol açar 1,3.
DILI’ye neden olan ajanlar iki şekilde sınıflandırılabilir: öngörülebilir doza bağımlı karaciğer hasarına neden olanlar veya nadir görülen ve ilaç dozundan, yoldan veya uygulama süresinden bağımsız olarak gelişen kendine özgü DILI’ye neden olanlar, ancak ABD’deki tüm akut karaciğer başarısızlıklarının altıda birinden sadece4. Ne yazık ki, ilaçlar ilaç geliştirme sürecinin klinik aşamalarına ulaşana kadar DILI genellikle tespit edilmez. İlaca bağlı karaciğer hasarı sıralaması (veya DILIrank), DILI’ye neden olma potansiyellerine göre dört sınıfa ayrılan binden fazla FDA onaylı ilaçtan oluşur ve hastalarda kullanımları yakından izlenmelidir5.
İlaç hepatotoksisitesinin mekanizmalarını incelemek çok zor olmaya devam etmektedir ve bu nedenle, DILI’nin mekanizmalarını araştırmak için birçok klinik öncesi model geliştirilmiştir. Preklinik gelişimde DILI’yi tahmin etmek için kullanılan mevcut in vitro ve in vivo modellerin, canlı bir insan vücudundaki karmaşık, çok yönlü etkileşimler hakkında fikir vermede çeşitli sınırlamaları vardır. 2D olarak kültürlenen kanserli hepatik hücre hatları (yani, HepG2, HepaRG), aday bileşiklerin toksisitesini değerlendirmek için ilaç geliştirmenin erken aşamalarında hala kullanılmaktadır6. Buna rağmen, bu hücre hatları tek donörlerden gelir ve anormal seviyelerde karaciğer fonksiyonu gösterir ve DILI 7,8’in tespiti için her zaman yüksek hassasiyet göstermez. Kanserli hepatik hücre hatlarına alternatif olarak, PHH’ler in vitro olarak uygun şekilde kültürlenirse insan karaciğer fizyolojisini daha iyi temsil eder, ancak kültürlerinde ilaçlarla kısa kuluçka süresi, nispeten kısa yaşam süresi, hepatik gen ekspresyonu kaybı ve ilaç metabolik fonksiyonlarındaki değişiklikler gibi çeşitli sınırlamalar vardır 9,10,11 . PHH’ler, standart 2D hücre kültürü plakalarındaki hücre dışı matris proteinleri üzerinde kültürlenebilir, ancak bir dezavantaj olarak, işlevlerindeki hızlı düşüş, DILI tahmini12 için düşük duyarlılığa (<% 50) sahip oldukları anlamına gelir.
Öte yandan, hayvan modelleri üzerinde yapılan testler yavaş, pahalıdır ve insanlara tahmini tahmin etmek için türler arası bir çeviriye ihtiyaç duyar. Yeni geliştirilen ilaçların çoğu onay alamayarak bu süreci maliyetli ve risklihale getirmektedir 5. Ayrıca, yeni insana özgü modaliteleri test etmek için, hayvan modelleri, insanlara karşı gen dizisi veya immünolojik yanıt farklılıkları nedeniyle daha az uygundur13.
Sonuç olarak, daha gelişmiş üç boyutlu (3D) in vitro karaciğer modellerine olan ilgi katlanarak artmıştır. PHH’lerin asılı damlalarda veya ultra düşük bağlantı yüzeylerinde yerçekimsel agregasyon ile üretilen küresel yapılar olarak kültürlenmesi, bileşik yükümlülükleri değerlendirmek için yüksek verimli bir yöntemi temsil eder14. PHH sferoidleri, DILI’yi hastalıklı bir arka planda (örneğin, steatoz ve kolestaz) değerlendirmek için kullanılmıştır15. Stromal fibroblastlı hepatositlerin kaplanmış mikro desenli kokültürlerini16, 3D biyo-baskılı karaciğer dokularını17, hepatik parankimal olmayan hücrelere sahip veya olmayan 3D sferoid kültürleri15 içerecek şekilde çok çeşitli modeller geliştirilmiştir. Bununla birlikte, tüm bu yöntemlerin hala dezavantajları vardır ve PHH’lerin fizyolojik olarak daha alakalı bir mikro ortamda kültürlenmesi, potansiyel hepatotoksikanlara uzun süre maruz kalmanın araştırılmasını sağlamak için uzun süre daha yüksek işlevsellik seviyeleri sağlayabilir. Ek olarak, herhangi bir gelişmiş in vitro PHH kültürünün translasyonel uygunluğunu iyileştirmek için, verilerin in vivo veya klinik senaryolarda karşılaştırılmasına izin vermek için klinik olarak ilgili fonksiyonel son noktalar veya toksisite çıkış biyobelirteçleri kullanılmalıdır18.
Bu çalışmada, karaciğer toksisitesinin ayrıntılı mekanik yönlerini anlamak için in vitro karaciğer modeli olarak da bilinen Çip Üzerinde Organ (OOC) olarak da bilinen bir MPS’nin kullanılıp kullanılamayacağını değerlendirdik. MPS’nin daha önce, akış altında, 4 haftaya kadar yüksek işlevselliğe sahip 3B karaciğer mikrodokularını koruduğu gösterilmiştir19. Sistem yakın zamanda FDA tarafından test edilmiş ve ilaç toksisitesi, metabolizması ve hücre içi birikim20 gerçekleştirirken yüksek tekrarlanabilirliğe sahip olduğu gösterilmiştir. Dahası, sferoidler ve sandviç kültürleri ile karşılaştırıldığında, sistem birkaç ilacın toksisitesini tespit etmede daha kararlı bir işleve ve daha yüksek duyarlılığa sahipti20. MPS, bugüne kadar ADME 21, hastalık modellemesi (HBV 22, NAFLD23,24,25) ve ilaç-ilaç etkileşimleri 26’yı kapsayan çok çeşitli uygulamalarda kullanılmış ve potansiyel olarak akut ve kronik DILI’nin değerlendirilmesi için son derece uygun hale gelmiştir. Burada sunulan teknoloji, daha geleneksel hücre kültürleri ve hayvan modelleri ile insan klinik çalışmaları arasındaki boşluğu kapatmak için bir alternatif sunarak, ilaç geliştirme sürecinin klinik öncesi aşamalarında aday bileşiklerin karaciğer toksisitesinin değerlendirilmesini desteklemek için insan biyolojik koşullarının simülasyonuna doğru ilerlemektedir.
Protocol
Representative Results
Discussion
MPS, insan organlarının fonksiyonel birimlerini in vitro olarak özetlemek üzere tasarlanmıştır ve geleneksel 3B hücre kültürü modellerinin sınırlamalarını ele almak üzere geliştirilmiştir27. Karaciğer, MPS kullanılarak en çok modellenen organlardan biridir ve çok çeşitli sistemler geliştirilmiştir. İnsan karaciğeri, ilaç metabolizmasından ve toksik ilaç metabolitlerinin üretilmesinden sorumludur ve işlevi, bileşiklerin DILI sorumluluğunun değerlendirilmesi de dahil olmak üzere ilaç geliştirme için modellemek için kilit bir unsurdur28. Burada, karaciğer MPS kullanarak DILI’yi değerlendirmek için yeni bir yöntem sunduk; protokol, DILI’ye nasıl neden olabileceğini belirlemek için test edilen her bileşik için mekanik içgörülerin aranmasını ve aynı zamanda son derece hassas ve sağlam bir tahlil olmasını sağlar. Karaciğer mikrodokuları, PHH ve HKC’lerin bir kokültürü olan ve standart in vitro karaciğer modelleri20’ye kıyasla yüksek düzeyde albümin ve üre üretiminin yanı sıra yüksek CYP3A4 aktivitesi ile oldukça işlevsel olan MPS plakalarında oluşur.
Burada açıklanan DİLİ modeli, ilaç geliştirme sürecinde klinik öncesi testlerin sonraki aşamalarında yararlı bir araç olarak hizmet edebilse de, bazı sınırlamaları da vardır. MPS’nin çoğunluğu şu anda piyasada bulunduğundan, düşük verimli bir platformdur ve bu nedenle büyük ölçekli uyuşturucu tarama faaliyetleri için kullanımı daha zordur. PPH’lerin ve HKC’lerin pıhtılaşmasıyla oluşan mikrodokulardan oluşan DILI modeli, insan karaciğerinin karmaşıklığını da tamamen yakalayamaz ve farklı hücre türlerini (örneğin, bağışıklık hücreleri) dahil ederek daha fazla optimizasyon, mevcut modele değer katmak için faydalı olacaktır. Bu tek organlı MPS, ortak bir ortamı paylaşabilen ve hücresel veya endokrin düzeyde organ çapraz konuşmasına izin verebilen ve yalnızca karaciğerin kendisiyle sınırlı olmayan toksisiteye ilişkin mekanik içgörülerin daha iyi anlaşılmasına yardımcı olabilecek diğer organ platformlarıyla da birleştirilebilir. Ayrıca, nispeten yeni herhangi bir teknoloji gibi, maliyetli ve dolayısıyla sınırlı erişilebilirlik olarak kabul edilebilir.
MPS, tek veya çok insanlı dokuların organotipik modellerini geliştirmek için kullanılan bir platformdur. Sistem bir kontrolör, göbek kablosu ve plakanın yerleştirildiği MPS sürücüsünden oluşur (Şekil 5A). Her karaciğer MPS plakası, birincil karaciğer hücrelerini mühendislik iskelelerinde 3D olarak kültürlemek için 12 bağımsız açık kuyuya sahiptir. Özetle, sistem QC tarafından kontrol edilir ve plakalar Gün -1’de astarlanır, PHH’ler ve HKC’ler sıfır Günü’nde plakalara yerleştirilir (Şekil 5B, bkz. 1). Gömülü mikro pompalar, 3D mikro dokuların oluşumunu kolaylaştırmak için hücre kültürü ortamının iskeleler aracılığıyla dolaşımını kolaylaştırır (Şekil 5B, bkz. 2). Oluşan mikro dokular 4. günde QC’d, 4 gün boyunca her 48 saatte bir her bileşiğin farklı konsantrasyonları ile dozlanır ve 8. günde son nokta biyobelirteçleri için test edilir (Şekil 5C). MPS plakasındaki DILI testinin deneysel zaman çizelgesi Şekil 5B’de gösterilmiştir.
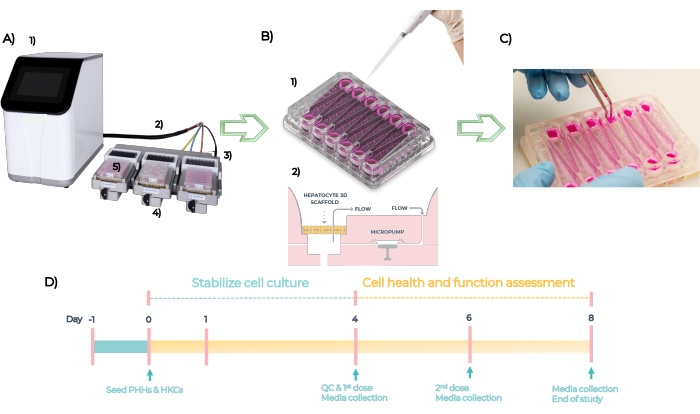
Şekil 5: Mikrofizyolojik sistem ve standart bir DILI testinin deneysel zaman çizelgesi. (A) Bileşenleri ile mikrofizyolojik sistem: kontrolör (1), göbek kablosu (2), yerleştirme istasyonu (3), MPS sürücüsü (4) ve LC12 plakası (5). (B) PH’lerin ve HKC’lerin LC12 plakası üzerine 1. Gün (1) ve gömülü mikropompalar üzerine tohumlanması, iskelelere tohumlanan 3D mikro dokular aracılığıyla ayarlanabilir akış hızlarına sahip hücre kültürü ortamının dolaşımını kolaylaştırır (2). (C) Çalışma sonunda iskelelerin yıkılması. (D) Deneysel zaman çizelgesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokolü gerçekleştirirken, başlamadan önce sağlam bir sistem QC kontrolünün yapılması, sistemin pnömatik olarak doğru çalışıp çalışmadığının kontrol edilmesi ve sarf malzemesi plakalarının görsel olarak incelenmesi ve tüm kuyularda eşit işlevsellik sağlamak için verimli bir şekilde astarlanması önemlidir. Yüksek kaliteli birincil insan hücrelerine sahip olmak, hücre kültürü deneylerinde tutarlı bir şekilde yapıştığı ve 3D etkileşimler oluşturduğu bilinen hepatositlerle bu protokol için çok önemlidir. Bu hücrelerin çözülmesi de kritik bir adımdır, çünkü birincil hepatositler pipetleme eylemi ile yeniden askıya alınmamalıdır, çünkü bu hızla hücre ölümüne yol açabilir. % 85’in üzerinde hücre canlılığına sahip olmak, başarılı tohumlama için kritik öneme sahiptir, çünkü büyük miktarda hücresel enkaz 3D mikrodoku oluşumuna müdahale edecektir. 4. Gün’de oluşan karaciğer mikrodokularının QC kontrolü de önemlidir ve kullanıcının kabul edilebilir LDH ve Üre seviyelerinin ölçülmesini sağlaması gerekir, çünkü aralık dışı parametreler düşük kaliteli doku oluşumunun göstergesi olabilir ve doğrudan sorun gidermeye izin verebilir. Son olarak, hücre kültürü ortamında kullanılan hidrokortizon, hepatositlerin metabolik işlevselliğini korumak için gerekli olduğu gibi, hücre kültürü işlevselliğini etkileyebilecek istenmeyen bozulmaları önlemek için kullanım gününde taze olarak hazırlanmalıdır.
Önemli karmaşıklığa sahip olmasına rağmen, karaciğer MPS, insan karaciğerinin tüm hücre tiplerini içermez. Fizyolojik alaka düzeyini artırmak içinmodel 24,29’a daha fazla hücre tipi eklemek mümkündür, ancak bunlar yalnızca kullanım bağlamı için açık bir gerekçe ile eklenmelidir. DILI üzerinde çalışmak için PHH anahtar hücre tipidir ve HKC’lerin bu modele dahil edilmesi bazı immünolojik yanıtların belirlenmesini sağlar. Ayrıca, insan karaciğerlerinden izole edilen PPH’lerin ve ticari olarak temin edilebilen kriyokorunmuş PPH’lerin lottan lota bazı farklılıklar gösterme eğiliminde olduğu da belirtilmelidir. Burada, bu protokolün, yüksek kaliteli hücre preparatları ile kullanıldığında tekrarlanabilir sonuçlar ürettiğini gösterdik. Bununla birlikte, bazı lot-lot varyasyonları beklenecektir ve bu, havuzlanmış çok sayıda çoklu bağışçı kullanılarak daha da aşılabilir. Bu sınırlamalar, PHH’lerin birçok fonksiyonel özelliğini özetleyen ve ilaç geliştirme sürecinde kullanılan iPSC’den farklılaşmış hepatosit benzeri hücreler kullanılarak aşılabilir30. HKC’ler ayrıca çözülme sırasında çok fazla değişkenlik ve yüksek düzeyde aktivasyon gösterir; Bu nedenle, HKC’lerin donörleri deneysel hücre kültüründe (doğrulanmış PHH’lerle kokültür) kullanılmadan önce şirket içinde önceden doğrulanır ve düşük çözülme sonrası aktivasyon seviyelerine sahip olmalıdır; bu, IL-6 ve TNF-alfa biyobelirteçleri ölçülerek değerlendirilir (bakınız Ek Materyal).
Burada sunulan veriler, tahlilin DILI’yi doğru bir şekilde tespit edebildiğini ve 2D10,11 ve hatta bazı 3D modeller tarafından tespit edilemeyen hepatotoksikanların tanımlanmasına yardımcı olduğunu doğrulamaktadır. MPS’den üretilen veriler, sahalar arası tekrarlanabilirlik20 dahil olmak üzere proses standardizasyonu ve uyumlaştırma eksikliği nedeniyle farmasötik endüstrisi tarafından düzenleyici sunumlar veya ilaç taraması amacıyla hala standart olarak kullanılmamaktadır. Burada gösterilen veriler ve deneysel yaklaşımlar bunu ele almakta ve karaciğer modelinin yeni bileşiklerin sorumluluğunu doğru bir şekilde tahmin etmek için DILI ekranlarında rutin ve sağlam bir şekilde kullanılabileceğini göstermektedir.
Bir “hepatotoksisite imzası” üretmek için bir dizi uç noktayı ölçerek, farklı seviyelerde DILI endişesine sahip bileşiklerin (diğer in vitro yöntemlerle tespit edilemeyen bileşikler dahil) ve bunların ortaya çıkan toksisite mekanizmalarının tanımlanmasına yardımcı olur. Bu teknoloji, bir tarafta geleneksel hücre kültürü ve hayvan modelleri ile insan klinik çalışmaları arasındaki boşluğu kapatabilir ve ilaç geliştirme sürecinin bir parçası olarak karaciğer toksisitesinin klinik öncesi değerlendirmesi için insan biyolojik koşullarının simülasyonuna doğru ilerleyebilir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
CN Bio Innovations Ltd. bu çalışmayı finanse etti.
Materials
| 24 well cell culture cluster plates flat bottom | Corning | 3524 | |
| 96 well clear assay plates, flat bottom clear plastic | Greiner | 655101 | |
| 96 well plates black flat bottom | Corning | 3915 | |
| 96 Well White/Clear Bottom Plate, TC Surface | ThermoScientific | 165306 | |
| Advanced DMEM (1x) | Gibco | 12491015 | Cell culture media. |
| AssayMax Albumin ELISA Kit | AssayPro | EA3201-1 | Dilution 1:250. Time point Day 4, 6, and 8. |
| Cell Maintenance Cocktail B, (Primary Hepatocyte Maintenance Supplements) | Gibco | CM4000 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | Dilution 1:1. Time point Day 8. |
| Chlorpromazine HCl | Sigma Aldrich | C8138 | |
| Chromacol blue lids, 9 mm Autosampler Vial Screw Thread Caps | ThermoScientific | 9-SCK(B)-ST1 | glass vial |
| Chromacol vials, 9 mm Clear Glass Screw Thread Vials | ThermoScientific | 2-SVW | |
| Class 2 Microbiological Safety Cabinets – Trimat2 1500 exhaust | Contained Air Solutions | ||
| Conical tubes 50 mL | Greiner | 227261 | |
| Cryopreserved Hepatocyte Recovery Medium (CHRM) | ThermoFisher Scientific | Gibco CM7000 | |
| Cryopreserved primary human hepatocytes | BioIVT Europe | Lot. RAS | |
| CytoTox 96 Cytotoxicty (LDH) Assay Kit | Promega | G1781 | Dilution – none. Time point Day 4, 6 and 8 |
| >Data analysis model used to generate the graph and EC:50 curves was nonlinear regression (curve fit) asymmetric sigmoidal, 5PL, where X is log(concentration | GraphPad Prism 9 | ||
| Disposable PES Filter Units 500mL | Fisher Scientific | 15913307 | |
| Disposable Pipette Basins 50ml | Fisher Scientific | 12369175 | |
| DMSO (Dimethyl sulfoxide) | Sigma-Aldrich | Sigma D2650 | |
| Dulbeco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | ThermoFisher Scientific | 14190-144 | |
| Easy Reader Conical Polypropylene Centrifuge Tubes 15 mL | Fisher Scientific | 11889640 | |
| Foetal bovine serum | Gibco | 10500064 | |
| Human ALT ELISA Kit | Abcam | ab 234578 | Dilution 1:5. Time point Day 6 and 8. |
| Human Cryopreserved Kupffer Cells | Lonza Europe | Lot. 190088KC | |
| hydrocortisone | Merck | H0888-1G | |
| Incubators models: New Brunswick Galaxy 170 S, New Brunswick Galaxy 170 R and CellXpert® C170. | Eppendorf | All serviced yearly; paperwork available upon request. | |
| Inverted Microscope | Leica DMIL LED | ||
| MPS know as Organ-on-a-Chip (OOC) | CN Bio Innovations Ltd. | ||
| MPS LC-12 plate | CN Bio Innovations Ltd. | ||
| Neubauer Improved C-Chip Disposable Haemocytometer (2 channel) | Cambridge Bioscience | DHC-N01-50 | |
| P450-Glo CYP3A4 Assay and Screening System | Promega | V9002 | Dilution – none. Time point Day 8 |
| PhysioMimix MPS platform | CN Bio Innovations Ltd. | ||
| Pioglitazone | MedChemExpress Tocris | HY-13956/CS-1700 | |
| Quantichrom Urea Assay Kit – Bioassay systems | Bioassay Systems | DY970-05 | Dilution 1:2 if initial reading is too high. Time point Day 4, 6 and 8. |
| Silica gel | Sigma-Aldrich | S7625 | |
| Software used to analyse and generate all the graphs was | GraphPad Prism 9 | ||
| Stripettes 10 mL | Fisher Scientific | 11839660 | |
| Stripettes 25 mL | Fisher Scientific | 11839181 | |
| Thawing plate Cocktail A, (Primary Hepatocyte Thawing and Plating Supplements) | Gibco | CM3000 | |
| Troglitazone | MedChemExpress Tocris | 97322-87-7 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Tubes 1.5 mL | Greiner | 616201 | |
| Weighing balance – model PA214C and AV213C | Ohaus Corp |
References
- Lisi, D. M. Drug-induced liver injury: An overview. US Pharmacist. 41 (12), 30-34 (2016).
- Kuna, L., et al. Models of drug induced liver injury (DILI)-current issues and future perspectives. Current Drug Metabolism. 19 (10), 830-838 (2018).
- Katarey, D., Verma, S. Drug-induced liver injury. Clinical Medicine. 16 (6), 104-109 (2016).
- Kullak-Ublick, G. A., et al. Drug-induced liver injury: recent advances in diagnosis and risk assessment Recent advances in clinical practice. Gut. 66, 1154-1164 (2017).
- Dirven, H., et al. Performance of pre-clinical models in predicting drug-induced liver injury in humans: a systematic review. Scientific Reports. 11 (1), 6403 (2021).
- Donato, M. T., Lahoz, A., Castell, J. V., Gomez-Lechon, M. J. Cell lines: a tool for in vitro drug metabolism studies. Current Drug Metabolism. 9 (1), 1-11 (2008).
- Wilkening, S., Stahl, F., Bader, A. Comparison of primary human hepatocytes and hepatoma cell line HepG2 with regard to their biotransformation properties. Drug Metabolism and Disposition. 31 (8), 1035-1042 (2003).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28 (2), 69-87 (2012).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical Research. 23 (7), 1482-1490 (2006).
- Li, F., Cao, L., Parikh, S., Zuo, R. Three-dimensional spheroids with primary human liver cells and differential roles of kupffer cells in drug-induced liver injury. Journal of Pharmaceutical Sciences. 109 (6), 1912-1923 (2020).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Lin, C., Khetani, S. R. Advances in engineered liver models for investigating drug-induced liver injury. BioMed Research International. 2016, 1829148 (2016).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regulatory Toxicology and Pharmacology. 32 (1), 56-67 (2000).
- Bell, C. C., et al. Comparison of hepatic 2D sandwich cultures and 3D spheroids for long-term toxicity applications: A multicenter study. Toxicological Sciences. 162 (2), 655-666 (2018).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Khetani, S. R., et al. Use of micropatterned co-cultures to detect compounds that cause drug-induced liver injury in humans. Toxicological Sciences. 132 (1), 107-117 (2013).
- Ma, X., et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proceedings of the National Academy of Sciences of the united States of America. 113 (8), 2206-2211 (2016).
- Dieterle, P. Y. M., Dieterle, F. Tissue-specific, non-invasive toxicity biomarkers: translation from pre-clinical safety assessment to clinical safety monitoring. Expert Opinion on Drug Metabolism & Toxicology. 5 (9), 1023-1038 (2009).
- Rowe, C., et al. Perfused human hepatocyte microtissues identify reactive metabolite-forming and mitochondria-perturbing hepatotoxins. Toxicology in Vitro. 46, 29-38 (2018).
- Rubiano, A., et al. Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation. Clinical and Translational Science. 14 (3), 1049-1061 (2021).
- Tsamandouras, N., Kostrzewski, T., Stokes, C. L., Griffith, L. G., Hughes, D. J., Cirit, M. Quantitative assessment of population variability in hepatic drug metabolism using a perfused three-dimensional human liver microphysiological system. Journal of Pharmacology and Experimental Therapeutics. 360 (1), 95-105 (2017).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological pre-clinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Kostrzewski, T., et al. Three-dimensional perfused human in vitro model of non-alcoholic fatty liver disease. World Journal of Gastroenterology. 23 (2), 204-215 (2017).
- Kostrzewski, T., et al. A microphysiological system for studying nonalcoholic steatohepatitis. Hepatology Communications. 4 (1), 77-91 (2020).
- Vacca, M., et al. Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis. Nature Metabolism. 2 (6), 514-531 (2020).
- Long, T. J., et al. Modeling therapeutic antibody-small molecule drug-drug interactions using a three-dimensional perfusable human liver co-culture platforms. Drug Metabolism and Disposition. 44, 1940-1948 (2016).
- Bai, J., Wang, C. Organoids and microphysiological systems: New tools for ophthalmic drug discovery. Frontiers in Pharmacology. 11, 407 (2020).
- Ribeiro, A. J. S., Yang, X., Patel, V., Madabushi, R., Strauss, D. G. Liver microphysiological systems for predicting and evaluating drug effects. Clinical Pharmacology & Therapeutics. 106 (1), 139-147 (2019).
- Clark, A. M., et al. A microphysiological system model of therapy for liver micrometastases hhs public access. Experimental Biology and Medicine (Maywood). 239 (9), 1170-1179 (2014).
- Qosa, H., Ribeiro, A. J. S., Hartman, N. R., Volpe, D. A. Characterization of a commercially available line of iPSC hepatocytes as models of hepatocyte function and toxicity for regulatory purposes. Journal of Pharmacological and Toxicological Methods. 110, 107083 (2021).

