Exploration de l’interaction biomoléculaire entre le chaperon moléculaire Hsp90 et sa protéine cliente Kinase Cdc37 à l’aide de la technologie de biodétection à effet de champ
Summary
La biodétection à effet de champ (FEB) est une technique sans étiquette permettant de détecter les interactions biomoléculaires. Il mesure le courant électrique à travers le biocapteur de graphène auquel les cibles de liaison sont immobilisées. La technologie FEB a été utilisée pour évaluer les interactions biomoléculaires entre Hsp90 et Cdc37 et une forte interaction entre les deux protéines a été détectée.
Abstract
Les interactions biomoléculaires jouent un rôle polyvalent dans de nombreux processus cellulaires en régulant et en coordonnant des événements biologiques fonctionnellement pertinents. Les biomolécules telles que les protéines, les glucides, les vitamines, les acides gras, les acides nucléiques et les enzymes sont des éléments constitutifs fondamentaux des êtres vivants; ils s’assemblent en réseaux complexes dans les biosystèmes pour synchroniser une myriade d’événements de la vie. Les protéines utilisent généralement des réseaux d’interactomes complexes pour remplir leurs fonctions; il est donc obligatoire d’évaluer de telles interactions pour démêler leur importance dans les cellules aux niveaux cellulaire et de l’organisme. Pour atteindre cet objectif, nous introduisons une technologie en émergence rapide, la biodétection à effet de champ (FEB), pour déterminer des interactions biomoléculaires spécifiques. FEB est une technique de détection biomoléculaire fiable et sans étiquette de paillasse pour déterminer des interactions spécifiques et utilise des biocapteurs électroniques de haute qualité. La technologie FEB peut surveiller les interactions dans la gamme nanomolaire en raison des nanomatériaux biocompatibles utilisés sur sa surface de biocapteur. Comme preuve de concept, l’interaction protéine-protéine (IPP) entre la protéine de choc thermique 90 (Hsp90) et le cycle de division cellulaire 37 (Cdc37) a été élucidée. Hsp90 est un chaperon moléculaire dépendant de l’ATP qui joue un rôle essentiel dans le repliement, la stabilité, la maturation et le contrôle de la qualité de nombreuses protéines, régulant ainsi de multiples fonctions cellulaires vitales. Cdc37 est considéré comme un chaperon moléculaire spécifique à la protéine kinase, car il reconnaît et recrute spécifiquement les protéines kinases à Hsp90 pour réguler leurs voies de transduction du signal en aval. En tant que tel, Cdc37 est considéré comme un co-chaperon de Hsp90. La voie chaperon-kinase (complexe Hsp90/Cdc37) est hyper-activée dans de multiples tumeurs malignes favorisant la croissance cellulaire; par conséquent, c’est une cible potentielle pour le traitement du cancer. La présente étude démontre l’efficacité de la technologie FEB à l’aide du système modèle Hsp90/Cdc37. Feb a détecté un fort IPP entre les deux protéines (valeurs KD de 0,014 μM, 0,053 μM et 0,072 μM dans trois expériences indépendantes). En résumé, FEB est une plate-forme de détection PPI sans étiquette et rentable, qui offre des mesures rapides et précises.
Introduction
Interactions biomoléculaires :
Les protéines sont des parties essentielles des organismes et participent à de nombreuses voies moléculaires telles que le métabolisme cellulaire, la structure cellulaire, la signalisation cellulaire, les réponses immunitaires, l’adhésion cellulaire, etc. Alors que certaines protéines remplissent leur(s) fonction(s) indépendamment, la plupart des protéines interagissent avec d’autres protéines en utilisant une interface de liaison pour coordonner l’activité biologique appropriée1.
Les interactions biomoléculaires peuvent principalement être classées en fonction des caractéristiques structurelles et fonctionnelles distinctes des protéines impliquées2, par exemple, en fonction des surfaces protéiques, de la stabilité complexe ou de la persistance des interactions3. L’identification des protéines essentielles et de leurs rôles dans les interactions biomoléculaires est essentielle pour comprendre les mécanismes biochimiques au niveau moléculaire4. Actuellement, il existe différentes approches pour détecter ces interactions5 : in vitro6, in silico7, dans les cellules vivantes8, ex vivo9 et in vivo10, chacune ayant ses propres forces et faiblesses.
Les essais in vivo sont effectués en utilisant l’animal entier comme outil expérimental11, et les essaisex vivo sont effectués sur des extraits de tissus ou des organes entiers (par exemple, le cœur, le cerveau, le foie) dans un environnement externe contrôlé en fournissant des altérations minimales dans les conditions naturelles. L’application la plus courante des études in vivo et ex vivo consiste à évaluer les effets pharmacocinétiques, pharmacodynamiques et toxiques d’agents pharmacologiques potentiels avant les essais chez l’homme en s’assurant de leur innocuité et de leur efficacitéglobales 12.
Les interactions biomoléculaires peuvent également être détectées au sein des cellules vivantes. L’imagerie des cellules vivantes nous permet d’observer des interactions dynamiques lorsqu’elles exécutent les réactions d’une voie biochimique particulière13. De plus, les techniques de détection, telles que la bioluminescence ou le transfert d’énergie par résonance de fluorescence, peuvent fournir des informations sur l’endroit et le moment où ces interactions se produisent dans la cellule14. Bien que la détection dans les cellules vivantes offre des détails cruciaux, ces méthodologies de détection reposent sur l’optique et les étiquettes, qui peuvent ne pas refléter la biologie native; ils sont également moins contrôlés que les méthodes in vitro et nécessitent une expertise spécialisée pour en effectuer15.
Les méthodes de calcul in silico sont principalement utilisées pour le criblage à grande échelle des molécules cibles avant les expériences in vitro . Les méthodes de prédiction computationnelle, les bases de données informatisées, l’amarrage moléculaire, les relations quantitatives structure-activité et d’autres approches de simulation de la dynamique moléculaire font partie des outils in silico bien établis16. Comparés à des techniques expérimentales laborieuses, les outils in silico peuvent facilement faire des prédictions avec une sensibilité élevée, mais avec une précision réduite dans les performances prédictives17.
Les essais in vitro sont effectués avec des micro-organismes ou des molécules biologiques en dehors de leur contexte biologique standard. La représentation des interactions biomoléculaires par des méthodes in vitro est essentielle à la compréhension des fonctions des protéines et de la biologie derrière le réseau complexe du fonctionnement cellulaire. La méthodologie de dosage préférée est choisie en fonction des propriétés intrinsèques de la protéine, des valeurs cinétiques et du mode et de l’intensité des interactions18,19.
L’interaction Hsp90/Cdc37 :
La voie chaperon-kinase, reliant Hsp90 et Cdc37, est une cible thérapeutique prometteuse en biologie tumorale20. Hsp90 joue un rôle central dans le contrôle du cycle cellulaire, l’assemblage des protéines, la survie cellulaire et les voies de signalisation. Les protéines qui dépendent de Hsp90 pour leurs fonctions sont livrées à Hsp90 pour la complexation par un co-chaperon, tel que Cdc37. Le complexe Hsp90/Cdc37 contrôle le repliement de la plupart des protéines kinases et sert de plaque tournante pour une multitude de réseaux de signalisation intracellulaire21. C’est une cible antitumorale prometteuse en raison de son expression élevée dans diverses tumeurs malignes, y compris la leucémie myéloblastique aiguë, le myélome multiple et le carcinome hépatocellulaire22,23.
Techniques de détection d’interactions biomoléculaires in vitro couramment utilisées
La co-immunoprécipitation (co-IP) est une technique qui repose sur la spécificité antigène-anticorps pour identifier les interactions biologiquement pertinentes24. Le principal inconvénient de cette méthode est son incapacité à détecter les interactions de faible affinité et les valeurs cinétiques24. Les méthodes biophysiques telles que la calorimétrie de titrage isotherme (ITC), la résonance plasmonique de surface (SPR), l’interférométrie biocouche (BLI) et la technologie FEB sont préférées pour déterminer les valeurs cinétiques.
ITC est une méthode de détection biophysique basée sur la détermination de l’énergie de liaison ainsi qu’une analyse thermodynamique complète pour caractériser les interactions biomoléculaires25. Le principal avantage de l’ITC est qu’il ne nécessite aucun marquage ou fixation de la protéine cible. Les principales difficultés rencontrées par l’ITC sont la forte concentration de protéines cibles requise pour une expérience et la difficulté d’analyser les complexes non covalents en raison de petites enthalpies de liaison26. Spr et BLI sont des techniques biophysiques sans étiquette qui reposent sur l’immobilisation de la molécule cible à la surface du capteur, suivie d’injections ultérieures de l’analyte sur la cible immobilisée27,28. Dans la SPR, les altérations de l’indice de réfraction au cours des interactions biomoléculaires sont mesurées27; dans BLI, l’interférence dans la lumière réfléchie est enregistrée en temps réel sous forme de changement de longueur d’onde en fonction du temps28. SPR et BLI partagent tous deux des avantages communs en offrant des capacités de spécificité, de sensibilité et de détection élevées29. Dans les deux méthodes, la protéine cible est immobilisée sur les surfaces des biocapteurs et, par conséquent, il peut y avoir une certaine perte de la conformation native de la cible, ce qui rend difficile la distinction entre les interactions spécifiques et non spécifiques30. BLI utilise des biocapteurs à fibre optique jetables coûteux pour immobiliser la cible, et est donc une technique coûteuse31. Par rapport à ces outils de détection biomoléculaire bien établis, la technologie FEB offre une plate-forme fiable et sans étiquette en utilisant de faibles concentrations nanomolaires pour la détection biomoléculaire en temps réel avec caractérisation cinétique. La technologie FEB surmonte également les défis bouillonnants rencontrés dans l’ITC et est plus rentable que SPR ou BLI.
Les biocapteurs à transistor à effet de champ (FET) sont un domaine émergent pour la détection des interactions biomoléculaires en offrant des applications biomédicales variées. Dans le système FET, les cibles sont immobilisées sur les puces de biocapteur et les interactions sont détectées par des changements de conductance32. La caractéristique unique à prendre en compte dans le développement d’un biocapteur électronique efficace réside dans les propriétés physico-chimiques telles que la nature semi-conductrice et la stabilité chimique du matériau de revêtement utilisé pour fabriquer la surface du capteur33. Les matériaux conventionnels comme le silicium utilisé pour le FET ont limité la sensibilité des capteurs car ils nécessitent des couches d’oxyde prises en sandwich entre le canal du transistor et un environnement spécifique pour un bon fonctionnement34. De plus, les transistors en silicium sont sensibles aux environnements riches en sel, ce qui rend difficile la mesure des interactions biologiques dans leur environnement naturel. Le biocapteur à base de graphène est présenté comme une alternative car il offre une excellente stabilité chimique et un champ électrique. Étant donné que le graphène est une seule couche atomique de carbone, il est à la fois extrêmement sensible en tant que semi-conducteur et chimiquement compatible avec les solutions biologiques; ces deux qualités sont souhaitables pour générer des biocapteurs électroniques compatibles35. Le remarquable potentiel de charge ultra-élevé des biomolécules offert par les biocapteurs revêtus de graphène conduit au développement de la technologie FEB des biocapteurs à base de graphène.
Principe de la technologie FEB: FEB est une technique de détection biomoléculaire sans étiquette qui mesure le courant électrique à travers le biocapteur de graphène auquel les cibles de liaison sont immobilisées. Les interactions entre la protéine immobilisée et l’analyte entraînent des altérations du courant qui sont surveillées en temps réel, ce qui permet des mesures cinétiques précises36.
Instrumentation : Le système FEB comprend une puce de capteur à transistor à effet de champ en graphène (gFET) et un lecteur électronique qui applique une tension constante tout au long de l’expérience (Figure 1). L’analyte est appliqué en solution sur la protéine cible immobilisée à la surface du biocapteur. Lorsqu’une interaction se produit, une altération du courant est mesurée et enregistrée en temps réel. Au fur et à mesure que la concentration de l’analyte augmente, la fraction d’analyte lié augmentera également, provoquant des alternances plus élevées dans le courant. À l’aide du logiciel d’analyse automatisé fourni avec l’instrument (Table des matériaux), I-Response est mesurée et enregistrée en termes d’unités de biodétection (BU)37. I-Response est définie comme l’altération du courant (I) à travers la puce de biocapteur mesurée en temps réel lors de l’interaction de la cible immobilisée avec l’analyte. Le logiciel d’analyse automatisé FEB peut analyser à la fois la réponse I et la réponse C aux événements d’interaction dynamique, où la réponse C enregistre les altérations de la capacité (C). Les variations de la réponse I et de la réponse C correspondent directement à la fraction de l’analyte lié et peuvent être analysées plus en détail pour générer des valeurs KD . La préférence par défaut du logiciel d’analyse automatisée est I-Response.
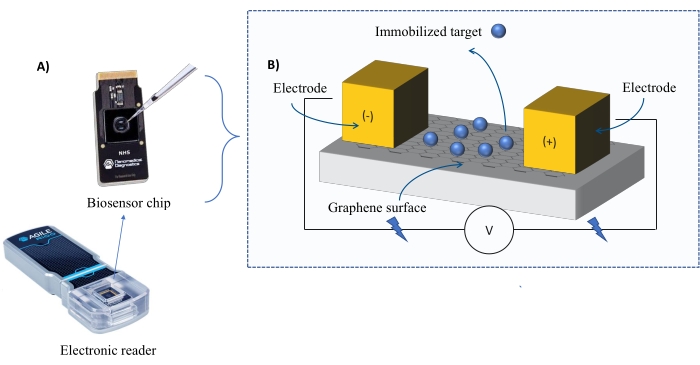
Figure 1: Vue d’ensemble de la configuration expérimentale. (A) Puce à base de graphène et lecteur électronique. (B) Une vue d’ensemble des composants de la puce. La puce est fixée à deux électrodes qui fournissent du courant au système. La surface de la puce est recouverte de graphène qui, lorsqu’il est activé, peut lier la cible. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Méthodologie:
Initialement, la puce de biocapteur activée est insérée dans le dispositif FEB (Figure 1) suivie de l’exécution des étapes décrites ci-dessous: (1) Étalonnage: L’expérience commence par l’étalonnage du système en utilisant 1x solution saline tamponnée au phosphate (PBS; pH = 7,4) pour créer la réponse d’équilibrage de base. (2) Association: L’analyte est introduit dans la puce et la réponse I est surveillée jusqu’à ce que la saturation de liaison soit atteinte. (3) Dissociation: L’analyte est dissocié à l’aide de 1x PBS. (4) Régénération: Les restes de l’analyte sont éliminés à l’aide de 1x PBS. (5) Lavage: Un total de cinq lavages sont effectués à l’aide de 1x PBS pour l’élimination complète des analytes liés et non liés de la puce.
Analyse:
L’analyse des données est effectuée à l’aide du logiciel entièrement automatisé fourni avec l’instrument. Le logiciel d’analyse automatisé génère un diagramme d’ajustement de Hill avec une valeur KD . Le diagramme d’ajustement de Hill décrit l’association d’un analyte à la protéine cible en fonction des concentrations d’analyte. La concentration à laquelle une réponse demi-maximale est obtenue est proportionnelle à la valeur KD . Une valeur KD faible représente une affinité de liaison élevée et vice versa.
Pour valider les données obtenues à partir de l’expérience FEB, les réponses I sont extraites de chaque point de lecture pour chaque concentration d’analyte à l’aide du logiciel d’examen/exportation des données et peuvent être exportées vers d’autres logiciels d’analyse statistique (voir tableau des matériaux) comme expliqué ci-dessous.
Protocol
Representative Results
Discussion
Dans cette étude, la faisabilité de l’utilisation de la technologie FEB (une approche de caractérisation cinétique en temps réel) a été évaluée pour déterminer l’interaction biomoléculaire entre Hsp90 et Cdc37. L’expérience exploratoire initiale (première expérience) suggérait que le choix des concentrations d’analyte appropriées est une partie essentielle de l’expérience et que l’expérience devrait être conçue en incluant des points de concentration au-dessus et au-dessous de la valeur K<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été soutenue par une subvention de la Binational Science Foundation (BSF) à S.K.S. et N.Q.
Materials
| Automated analysis software | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
Referred to in the text as the automated analysis software supplied with the instrument. Generates automated analysis. |
| COOH-BPU (Biosensing Processing Unit) | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
biosensor chip |
| Data review software | Datalign 1.0, Cardea (Nanomed) | NA CAS number: NA |
Referred to as the supplied data review software in the text. Supplied with the instrument and allows to review and export the information data points. |
| Dialysis bag | CelluSep, Membrane filtration products | T2-10-15 CAS number: NA |
T2 tubings (6,000-8,000 MWCO), (10 mm fw, 6.4mm Ø, 0.32ml/cm, 15m) |
| EDC (1-Ethyl-3-(3-dimethylamino propyl) carbodiimide) | Cardea (Nanomed) | EDC160322-02 CAS number: 25952-53-8 |
White powder |
| ITC (Isothermal titration calorimetry) system | Microcal-PEAQ-ITC (Malvern, United Kingdom) | NA CAS number: NA |
|
| MES (2-(N-morpholino) ethane sulfonic acid) buffer | Merck | M3671-50G CAS number: 4432-31-9 |
White powder |
| NHS (N-Hydroxysulfosuccinimide) chips | Cardea (Nanomed) | NA CAS number: NA |
Graphene-based chip |
| PBS (Phosphate-buffered saline) X 10 | Bio-Lab | 001623237500 CAS number: 7758-11-4 |
Liquid transparent solution |
| Pipete | Thermo Scientific | 11855231 CAS number: NA |
Finnpipette F3 5-50 µL, yellow |
| Quench 1 (3.9 mM amino-PEG5-alcohol in 1 X PBS) | Cardea (Nanomed) | 0105-001-002-001 CAS number: NA |
Liquid, transparent solution |
| Quench 2 (1 M ethanolamine (pH=8.5)) | Cardea (Nanomed) | 0105-001-003-001 CAS number: NA |
Liquid, transparent solution |
| Recombinant protein Cdc37 | Abcam | ab256157 CAS number: NA |
|
| Recombinant protein Hsp90 beta | Abcam | ab80033 CAS number: NA |
|
| Spreadsheet | Excel, Microsoft office | NA CAS number: NA |
|
| Statistical software | GraphPad, Prism | NA CAS number: NA |
Referred to as the other statistical software. Sigma plot, phyton or other statistical programes may also be used |
| Sulfo-NHS | Cardea (Nanomed) | NHS160321-07 CAS number: 106627-54-7 |
White powder |
| Tips | Alex red | LC 1093-800-000 CAS number: NA |
Tip 1-200 µl, in bulk, 1,000 pcs |
References
- Tuncbag, N., Gursoy, A., Guney, E., Nussinov, R., Keskin, O. Architectures and functional coverage of protein-protein interfaces. Journal of Molecular Biology. 381 (3), 785-802 (2008).
- Berggård, T., Linse, S., James, P. Methods for the detection and analysis of protein–protein interactions. Proteomics. 7 (16), 2833-2842 (2007).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: Scope and mechanism. Journal of the American Chemical Society. 127 (1), 146-157 (2005).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Nguyen, T. N., Goodrich, J. A. Protein-protein interaction assays: Eliminating false positive interactions. Nature Methods. 3 (2), 135-139 (2006).
- Fernández-Suárez, M., Chen, T. S., Ting, A. Y. Protein-protein interaction detection in vitro and in cells by proximity biotinylation. Journal of the American Chemical Society. 130 (29), 9251-9253 (2008).
- Jiang, M., Niu, C., Cao, J., Ni, D. -. A., Chu, Z. In silico-prediction of protein–protein interactions network about MAPKs and PP2Cs reveals a novel docking site variants in Brachypodium distachyon. Scientific Reports. 8 (1), 15083 (2018).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nature Biotechnology. 27 (10), 941-945 (2009).
- Wang, W., Goodman, M. T. Antioxidant property of dietary phenolic agents in a human LDL-oxidation ex vivo model: Interaction of protein binding activity. Nutrition Research. 19 (2), 191-202 (1999).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Qvit, N., Disatnik, M. -. H., Sho, E., Mochly-Rosen, D. Selective phosphorylation inhibitor of delta protein kinase C–Pyruvate dehydrogenase kinase protein–protein interactions: Application for myocardial injury in vivo. Journal of the American Chemical Society. 138 (24), 7626-7635 (2016).
- Alam, M. N., Bristi, N. J., Rafiquzzaman, M. Review on in vivo and in vitro methods evaluation of antioxidant activity. Saudi Pharmaceutical Journal. 21 (2), 143-152 (2013).
- Paulmurugan, R., Gambhir, S. S. Novel fusion protein approach for efficient high-throughput screening of small molecule–mediating protein-protein interactions in cells and living animals. Cancer Research. 65 (16), 7413-7420 (2005).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Deriziotis, P., Graham, S. A., Estruch, S. B., Fisher, S. E. Investigating protein-protein interactions in live cells using bioluminescence resonance energy transfer. Journal of Visualized Experiments: JoVE. (87), e51438 (2014).
- Ekins, S., Mestres, J., Testa, B. In silico pharmacology for drug discovery: Methods for virtual ligand screening and profiling. British Journal of Pharmacology. 152 (1), 9-20 (2007).
- Valerio, L. G. Application of advanced in silico methods for predictive modeling and information integration. Expert Opinion on Drug Metabolism & Toxicology. 8 (4), 395-398 (2012).
- Piehler, J. New methodologies for measuring protein interactions in vivo and in vitro. Current Opinion in Structural Biology. 15 (1), 4-14 (2005).
- Ideker, T., Sharan, R. Protein networks in disease. Genome Research. 18 (4), 644-652 (2008).
- Lu, H., et al. Recent advances in the development of protein–protein interactions modulators: mechanisms and clinical trials. Signal Transduction and Targeted Therapy. 5 (1), 213 (2020).
- Jarosz, D. Hsp90: A global regulator of the genotype-to-phenotype map in cancers. Advances in Cancer Research. 129, 225-247 (2016).
- Johnson, V. A., Singh, E. K., Nazarova, L. A., Alexander, L. D., McAlpine, S. R. Macrocyclic inhibitors of Hsp90. Current Topics in Medicinal Chemistry. 10 (14), 1380-1402 (2010).
- Mahalingam, D., et al. Targeting HSP90 for cancer therapy. British Journal of Cancer. 100 (10), 1523-1529 (2009).
- Stewart, A., Fisher, R. A. Co-Immunoprecipitation: Isolation of protein signaling complexes from native tissues. Methods in Cell Biology. 112, 33-54 (2012).
- Pierce, M. M., Raman, C. S., Nall, B. T. Isothermal titration calorimetry of protein-protein interactions. Methods. 19 (2), 213-221 (1999).
- Paketurytė, V., et al. Inhibitor binding to carbonic anhydrases by isothermal titration calorimetry. Carbonic Anhydrase as Drug Target. , 79-95 (2019).
- Grote, J., Dankbar, N., Gedig, E., Koenig, S. Surface plasmon resonance/mass spectrometry interface. Analytical Chemistry. 77 (4), 1157-1162 (2005).
- Kumaraswamy, S., Tobias, R. Label-free kinetic analysis of an antibody–antigen interaction using biolayer interferometry. Methods in Molecular Biology. , 165-182 (2015).
- Wallner, J., Lhota, G., Jeschek, D., Mader, A., Vorauer-Uhl, K. Application of bio-layer interferometry for the analysis of protein/liposome interactions. Journal of Pharmaceutical and Biomedical Analysis. 72, 150-154 (2013).
- Singh, A. N., Ramadan, K., Singh, S. Experimental methods to study the kinetics of protein–protein interactions. Advances in Protein Molecular and Structural Biology Methods. , 115-124 (2022).
- Frenzel, D., Willbold, D. Kinetic titration series with biolayer interferometry. PLoS One. 9 (9), 106882 (2014).
- Vu, C. -. A., Chen, W. -. Y. Field-effect transistor biosensors for biomedical applications: Recent advances and future prospects. Sensors. 19 (19), 4214 (2019).
- Bergveld, P. A critical evaluation of direct electrical protein detection methods. Biosensors & Bioelectronics. 6 (1), 55-72 (1991).
- Lowe, B. M., Sun, K., Zeimpekis, I., Skylaris, C. K., Green, N. G. Field-effect sensors – from pH sensing to biosensing: sensitivity enhancement using streptavidin–biotin as a model system. The Analyst. 142 (22), 4173-4200 (2017).
- Goldsmith, B. R., et al. Digital biosensing by foundry-fabricated graphene sensors. Scientific Reports. 9 (1), 434 (2019).
- Afsahi, S., et al. Novel graphene-based biosensor for early detection of Zika virus infection. Biosensors and Bioelectronics. 100, 85-88 (2018).
- Afsahi, S. J., et al. Towards novel graphene-enabled diagnostic assays with improved signal-to-noise ratio. MRS Advances. 2 (60), 3733-3739 (2017).
- Roe, S. M., et al. The mechanism of Hsp90 regulation by the protein kinase-specific cochaperone p50cdc37. Cell. 116 (1), 87-98 (2004).
- Gaiser, A. M., Kretzschmar, A., Richter, K. Cdc37-Hsp90 complexes are responsive to nucleotide-induced conformational changes and binding of further cofactors. The Journal of Biological Chemistry. 285 (52), 40921-40932 (2010).
- Popescu, A. I., Găzdaru, D. M., Chilom, C. G., Bacalum, M. Biophysical interactions: Their paramount importance for life. Romanian Reports in Physics. 65 (3), 1063-1077 (2013).
- Surya, S., Abhilash, J., Geethanandan, K., Sadasivan, C., Haridas, M. A profile of protein-protein interaction: Crystal structure of a lectin-lectin complex. International Journal of Biological Macromolecules. 87, 529-536 (2016).
- Velazquez-Campoy, A., Freire, E. ITC in the post-genomic era…? Priceless. Biophysical Chemistry. 115 (23), 115-124 (2005).
- Concepcion, J., et al. Label-free detection of biomolecular interactions using bioLayer interferometry for kinetic characterization. Combinatorial Chemistry & High Throughput Screening. 12 (8), 791-800 (2009).
- Helmerhorst, E., Chandler, D. J., Nussio, M., Mamotte, C. D. Real-time and label-free bio-sensing of molecular interactions by surface plasmon resonance: A laboratory medicine perspective. The Clinical Biochemist. Reviews. 33 (4), 161-173 (2012).
- Jacob, N. T., et al. Synthetic molecules for disruption of the MYC protein-protein interface. Bioorganic & Medicinal Chemistry. 26 (14), 4234-4239 (2018).

