Atomic Force Microscopie om de fysieke eigenschappen van epidermale cellen van levende Arabidopsis-wortels te bestuderen
Summary
Het atoomkrachtmicroscopie-inkepingsprotocol biedt de mogelijkheid om de rol van de fysische eigenschappen van de celwand van een bepaalde cel van een weefsel of orgaan te ontleden tijdens normale of beperkte groei (d.w.z. onder watertekort).
Abstract
Hier wordt een methode beschreven om de fysische eigenschappen van de celwand van epidermale cellen van levende Arabidopsiswortels te karakteriseren door middel van nano-indentaties met een atoomkrachtmicroscoop (AFM) in combinatie met een optische omgekeerde fluorescentiemicroscoop. De methode bestaat uit het toepassen van gecontroleerde krachten op het monster tijdens het meten van de vervorming, waardoor parameters zoals de schijnbare Young’s modulus van celwanden bij subcellulaire resoluties kunnen worden gekwantificeerd. Het vereist een zorgvuldige mechanische immobilisatie van het monster en een juiste selectie van inspringers en inkepingsdiepten. Hoewel het alleen in externe weefsels kan worden gebruikt, maakt deze methode het mogelijk om mechanische veranderingen in de celwanden van planten tijdens de ontwikkeling te karakteriseren en maakt het de correlatie van deze microscopische veranderingen met de groei van een heel orgaan mogelijk.
Introduction
Plantencellen worden omgeven door een celwand die een complexe structuur is die bestaat uit op elkaar inwerkende netwerken van polysacchariden, eiwitten, metabolieten en water die in dikte varieert van 0,1 tot enkele μm, afhankelijk van het celtype en de groeifase 1,2. Celwand mechanische eigenschappen spelen een essentiële rol bij de groei van planten. Lage stijfheidswaarden van de celwand zijn voorgesteld als een voorwaarde voor celgroei en celwanduitbreiding, en er is steeds meer bewijs dat alle cellen mechanische krachten voelen om hun functies uit te voeren. Er wordt echter nog steeds gediscussieerd of veranderingen in de fysieke eigenschappen van de celwand het lot van de cel bepalen 2,3,4. Omdat plantencellen niet bewegen tijdens de ontwikkeling, hangt de uiteindelijke vorm van een orgaan af van hoe ver en in welke richting een cel uitzet. Arabidopsiswortel is dus een goed model om de impact van fysieke eigenschappen van celwand in celexpansie te bestuderen, omdat verschillende soorten expansie voorkomen in verschillende regio’s van de wortel. Anisotrope expansie is bijvoorbeeld duidelijk in de rekzone en vooral merkbaar in de epidermale cellen5.
De hier beschreven methode werd gebruikt om de fysische eigenschappen van de celwand van epidermale cellen op nanoschaal van levende Arabidopsis-wortels te karakteriseren met behulp van een Atomic Force Microscope (AFM) in combinatie met een omgekeerde fluorescentiefasemicroscoop6. Voor een uitgebreide herziening van de AFM-techniek, lees 7,8,9.
Dit protocol schetst een basismethode voor monstervoorbereiding en een algemene methode voor afm-gebaseerde elasticiteitsmetingen van plantencelwanden.
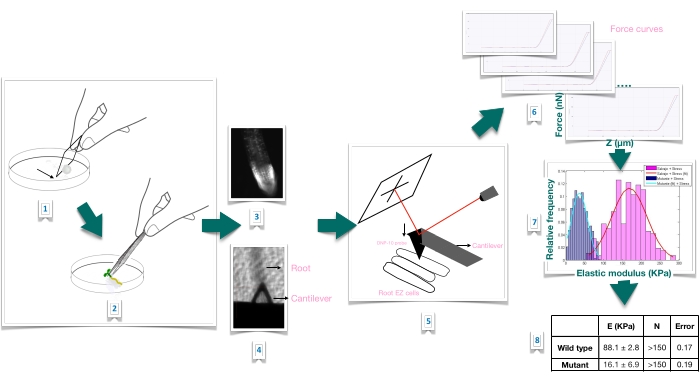
Figuur 1: Schematisch overzicht van kracht-indentatie experiment in Arabidopsis wortels met behulp van atomic force microscopie (AFM). Het schema geeft een overzicht van de stappen van een Force-Indentation-experiment vanaf de voorbereiding van het substraat om het wortelmonster stevig te immobiliseren (1-2), bevestiging van de levensvatbaarheid van de wortel door propidiumjodidekleuring (3), cantileverpositionering op het oppervlak van een langwerpige epidermale cel van de primaire wortel (4-5), krachtcurvemeting (6) en krachtcurveverwerking om de schijnbare Young’s modulus te berekenen (7-8). EZ: rekzone. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Cel- en celwandmechanica worden steeds relevanter om inzicht te krijgen in hoe mechanica groeiprocessen beïnvloedt. Naarmate fysieke krachten zich over aanzienlijke afstanden in vaste weefsels voortplanten, wordt de studie van veranderingen in de fysieke eigenschappen van de celwand en hoe ze worden waargenomen, gecontroleerd, afgestemd en de groei van de plant beïnvloeden, een belangrijk studiegebied 2,3,8.
<p class="jove…Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd gefinancierd door CSIC I+D 2018, subsidie nr. 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) en PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

