Rasterkraftmikroskopie zur Untersuchung der physikalischen Eigenschaften epidermaler Zellen lebender Arabidopsiswurzeln
Summary
Das Rasterkraftmikroskopie-Eindringprotokoll bietet die Möglichkeit, die Rolle der physikalischen Eigenschaften der Zellwand einer bestimmten Zelle eines Gewebes oder Organs während des normalen oder eingeschränkten Wachstums (d.h. unter Wasserdefizit) zu analysieren.
Abstract
Hier wird eine Methode beschrieben, um die physikalischen Eigenschaften der Zellwand epidermaler Zellen lebender Arabidopsiswurzeln durch Nanoindentationen mit einem Rasterkraftmikroskop (AFM) gekoppelt mit einem optischen inversen Fluoreszenzmikroskop zu charakterisieren. Die Methode besteht darin, kontrollierte Kräfte auf die Probe anzuwenden, während ihre Verformung gemessen wird, wodurch Parameter wie der scheinbare Elastizitätsmodul der Zellwände bei subzellulärer Auflösung quantifiziert werden können. Es erfordert eine sorgfältige mechanische Immobilisierung der Probe und die richtige Auswahl der Eindringkörper und Eindringtiefen. Obwohl es nur in äußeren Geweben verwendet werden kann, ermöglicht diese Methode die Charakterisierung mechanischer Veränderungen in pflanzlichen Zellwänden während der Entwicklung und ermöglicht die Korrelation dieser mikroskopischen Veränderungen mit dem Wachstum eines ganzen Organs.
Introduction
Pflanzenzellen sind von einer Zellwand umgeben, die eine komplexe Struktur ist, die aus interagierenden Netzwerken von Polysacchariden, Proteinen, Metaboliten und Wasser besteht, deren Dicke je nach Zelltyp und Wachstumsphase von 0,1 bis zu mehreren μm variiert 1,2. Die mechanischen Eigenschaften der Zellwand spielen eine wesentliche Rolle beim Wachstum von Pflanzen. Niedrige Steifigkeitswerte der Zellwand wurden als Voraussetzung für Zellwachstum und Zellwanderweiterung vorgeschlagen, und es gibt zunehmend Hinweise darauf, dass alle Zellen mechanische Kräfte wahrnehmen, um ihre Funktionen zu erfüllen. Es wird jedoch noch diskutiert, ob Veränderungen in den physikalischen Eigenschaften der Zellwand das Zellschicksalbestimmen 2,3,4. Da sich Pflanzenzellen während der Entwicklung nicht bewegen, hängt die endgültige Form eines Organs davon ab, wie weit und in welche Richtung sich eine Zelle ausdehnt. Daher ist die Arabidopsis-Wurzel ein gutes Modell, um den Einfluss der physikalischen Eigenschaften der Zellwand auf die Zellexpansion zu untersuchen, da verschiedene Arten der Expansion in verschiedenen Regionen der Wurzel auftreten. So zeigt sich die anisotrope Expansion in der Dehnungszone und besonders deutlich in den Epidermiszellen5.
Die hier beschriebene Methode wurde verwendet, um die physikalischen Eigenschaften der Zellwand epidermaler Zellen auf der Nanoskala lebender Arabidopsis-Wurzeln mit einem Rasterkraftmikroskop (AFM) gekoppelt mit einem inversen Fluoreszenzphasenmikroskop6 zu charakterisieren. Für eine umfassende Überarbeitung der AFM-Technik lesen Sie 7,8,9.
Dieses Protokoll beschreibt eine grundlegende Probenvorbereitungsmethode und eine allgemeine Methode zur AFM-basierten Elastizitätsmessung pflanzlicher Zellwände.
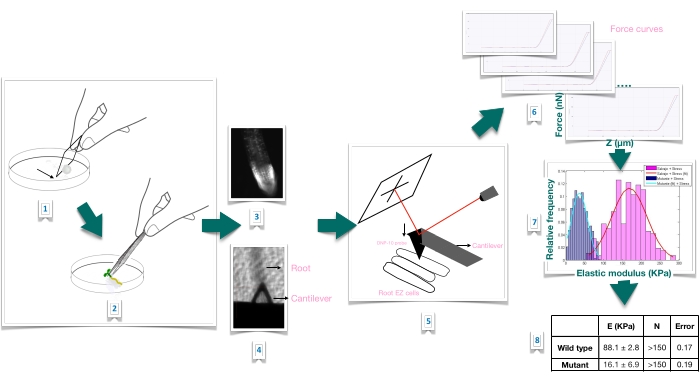
Abbildung 1: Schematische Übersicht des Krafteindringexperiments in Arabidopsis-Wurzeln mittels Rasterkraftmikroskopie (AFM). Das Schema gibt einen Überblick über die Schritte eines Kraft-Eindring-Experiments von der Vorbereitung des Substrats zur festen Immobilisierung der Wurzelprobe (1-2), der Bestätigung der Wurzellebensfähigkeit durch Propidiumiodidfärbung (3), der Cantilever-Positionierung auf der Oberfläche einer länglichen Epidermiszelle der Primärwurzel (4-5), der Messung von Kraftkurven (6) und der Kraftkurvenverarbeitung zur Berechnung des scheinbaren Elastizitätsmoduls (7-8). EZ: Dehnungszone. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die Zell- und Zellwandmechanik wird immer relevanter, um Erkenntnisse darüber zu gewinnen, wie die Mechanik Wachstumsprozesse beeinflusst. Da sich physikalische Kräfte über beträchtliche Entfernungen in festen Geweben ausbreiten, wird die Untersuchung von Veränderungen in den physikalischen Eigenschaften der Zellwand und wie sie wahrgenommen, kontrolliert, abgestimmt und auf das Wachstum der Pflanze beeinflusst werden, zu einem wichtigen Forschungsgebiet 2,3,8</su…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde gefördert durch CSIC I+D 2018, Grant No. 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) und PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

