Microscopia a forza atomica per studiare le proprietà fisiche delle cellule epidermiche delle radici vive di Arabidopsis
Summary
Il protocollo di indentazione della microscopia a forza atomica offre la possibilità di sezionare il ruolo delle proprietà fisiche della parete cellulare di una particolare cellula di un tessuto o organo durante la crescita normale o limitata (cioè in deficit idrico).
Abstract
Un metodo è descritto qui per caratterizzare le proprietà fisiche della parete cellulare delle cellule epidermiche delle radici viventi di Arabidopsis attraverso nanoindentazioni con un microscopio a forza atomica (AFM) accoppiato con un microscopio ottico a fluorescenza invertita. Il metodo consiste nell’applicare forze controllate al campione misurandone la deformazione, consentendo di quantificare parametri come l’apparente modulo di Young delle pareti cellulari a risoluzioni subcellulari. Richiede un’attenta immobilizzazione meccanica del campione e una corretta selezione dei penetratori e delle profondità di indentazione. Sebbene possa essere utilizzato solo nei tessuti esterni, questo metodo consente di caratterizzare i cambiamenti meccanici nelle pareti cellulari delle piante durante lo sviluppo e consente la correlazione di questi cambiamenti microscopici con la crescita di un intero organo.
Introduction
Le cellule vegetali sono circondate da una parete cellulare che è una struttura complessa composta da reti interagenti di polisaccaridi, proteine, metaboliti e acqua che varia in spessore da 0,1 a diversi μm a seconda del tipo di cellula e della fase di crescita 1,2. Le proprietà meccaniche della parete cellulare svolgono un ruolo essenziale nella crescita delle piante. Bassi valori di rigidità della parete cellulare sono stati proposti come precondizione per la crescita cellulare e l’espansione della parete cellulare, e vi è una crescente evidenza che tutte le cellule percepiscono le forze meccaniche per svolgere le loro funzioni. Tuttavia, è ancora dibattuto se i cambiamenti nelle proprietà fisiche della parete cellulare determinino il destino cellulare 2,3,4. Poiché le cellule vegetali non si muovono durante lo sviluppo, la forma finale di un organo dipende da quanto lontano e in quale direzione una cellula si espande. Pertanto, la radice di Arabidopsis è un buon modello per studiare l’impatto delle proprietà fisiche della parete cellulare nell’espansione cellulare perché diversi tipi di espansione si verificano in diverse regioni della radice. Ad esempio, l’espansione anisotropa è evidente nella zona di allungamento e in particolare nelle cellule epidermiche5.
Il metodo qui descritto è stato utilizzato per caratterizzare le proprietà fisiche della parete cellulare delle cellule epidermiche su scala nanometrica delle radici viventi di Arabidopsis utilizzando un microscopio a forza atomica (AFM) accoppiato con un microscopio a fase di fluorescenza invertita6. Per una revisione approfondita della tecnica AFM, leggere 7,8,9.
Questo protocollo delinea un metodo di preparazione del campione di base e un metodo generale per le misurazioni dell’elasticità basate su AFM delle pareti cellulari delle piante.
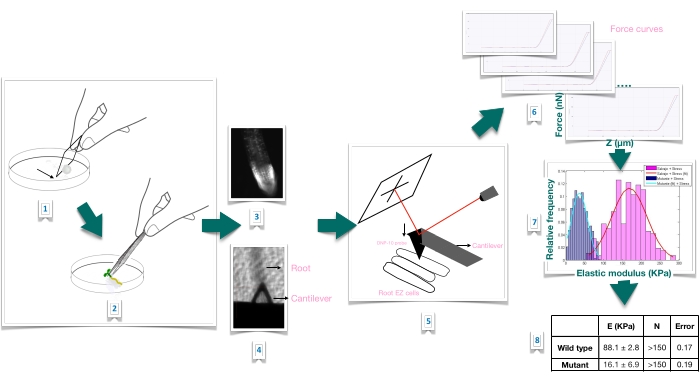
Figura 1: Panoramica schematica dell’esperimento di indentazione della forza nelle radici di Arabidopsis utilizzando la microscopia a forza atomica (AFM). Lo schema fornisce una panoramica delle fasi di un esperimento di forza-indentazione dalla preparazione del substrato per immobilizzare saldamente il campione radicale (1-2), conferma della vitalità della radice attraverso colorazione con ioduro di propidio (3), posizionamento a sbalzo sulla superficie di una cellula epidermica allungata della radice primaria (4-5), misurazione delle curve di forza (6) e elaborazione della curva di forza per calcolare il modulo di Young apparente (7-8). EZ: zona di allungamento. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
La meccanica delle cellule e della parete cellulare sta diventando sempre più rilevante per ottenere informazioni su come la meccanica influisce sui processi di crescita. Poiché le forze fisiche si propagano su distanze considerevoli nei tessuti solidi, lo studio dei cambiamenti nelle proprietà fisiche della parete cellulare e di come vengono rilevati, controllati, sintonizzati e influenzano la crescita della pianta stanno diventando un importante campo di studio 2,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata finanziata da CSIC I + D 2018, sovvenzione n. 95 (Mariana Sotelo Silveira). CSIC Grupos (Omar Borsani) e PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

