نوع الألياف والتحليل الخاص بالخلايا لمحتوى قطرات الدهون في العضلات الهيكلية
Summary
تشير الأدلة المتزايدة إلى أن التسلل المفرط للدهون داخل العضلات الهيكلية يؤدي إلى السمية الدهنية ومرض السكري. هنا ، نقدم بروتوكولا كاملا ، بما في ذلك معالجة الأنسجة ، والتلطيخ باستخدام Bodipy ، والحصول على الصور ، وتحليلها ، لتحديد حجم وكثافة وتوزيع قطرات الدهون تحت الخلوية بطريقة محددة من نوع الألياف.
Abstract
يزداد تسلل الدهون في العضلات الهيكلية ، والمعروف باسم myosteatosis ، مع السمنة والشيخوخة. كما تم اكتشاف Myosteatosis مؤخرا كعامل تنبؤي سلبي للعديد من الاضطرابات الأخرى مثل أمراض القلب والأوعية الدموية والسرطان. التسلل المفرط للدهون يقلل من كتلة العضلات وقوتها. كما أنه يؤدي إلى السمية الشحمية ومقاومة الأنسولين اعتمادا على إجمالي محتوى الدهون داخل الخلايا ، ومورفولوجيا قطرات الدهون (LD) ، والتوزيع دون الخلوي. نوع الألياف (المؤكسد مقابل تحلل السكر) مهم أيضا ، لأن الألياف المؤكسدة لديها قدرة أكبر على استخدام الدهون. بسبب آثارها الحاسمة في الفيزيولوجيا المرضية ، هناك ما يبرر إجراء دراسات متعمقة حول ديناميكيات LD ووظيفتها بطريقة خاصة بنوع الألياف.
هنا ، يتم تقديم بروتوكول كامل لتحديد كمية محتوى الدهون intramyocellular وتحليل مورفولوجيا LD والتوزيع دون الخلوي بطريقة خاصة بنوع الألياف. تحقيقا لهذه الغاية ، تم تلطيخ عمليات تبريد العضلات التسلسلية بصبغة الفلورسنت Bodipy والأجسام المضادة ضد متساوي السلسلة الثقيلة الميوسين. يتيح هذا البروتوكول المعالجة المتزامنة للعضلات المختلفة ، وتوفير الوقت وتجنب القطع الأثرية المحتملة ، وبفضل ماكرو شخصي تم إنشاؤه في فيجي ، أصبح من الممكن أيضا أتمتة تحليل LD.
Introduction
يزداد تسلل الدهون في العضلات الهيكلية ، والمعروف باسم myosteatosis ، مع السمنة والشيخوخة. يرتبط Myosteatosis سلبا بكتلة العضلات وقوتها ومع حساسية الأنسولين1. علاوة على ذلك ، تشير الدراسات الحديثة إلى أنه يمكن استخدام درجة تنخر العظم العضلي كعامل تنبؤي لحالات أخرى مثل أمراض القلب والأوعية الدموية2 أو مرض الكبد الدهني غير الكحولي3 أو السرطان4. يمكن أن تتراكم الدهون في العضلات الهيكلية بين ألياف العضلات كدهون خارج الخلية أو داخل الألياف ، مثل الدهون داخل الخلايا (IMCLs). يتم تخزين IMCLs في الغالب كدهون ثلاثية في قطرات الدهون (LDs) التي تستخدم كوقود استقلابي أثناء التمرين البدني 5,6. ومع ذلك ، عندما يتجاوز عرض الدهون الطلب ، أو عندما تصبح الميتوكوندريا مختلة وظيفيا ، فإن IMCLs سوف تكون متورطة في مقاومة الأنسولين العضلي ، كما هو موضح في الأفراد غير الأصحاء والسمنة الأيضية وفي مرضى السكري من النوع 27. ومن المثير للاهتمام ، أن رياضيي التحمل لديهم مستويات مماثلة ، إن لم تكن أعلى ، من IMCLs لتلك الموجودة في المرضى الذين يعانون من السمنة المفرطة مع داء السكري من النوع 2 ، مع الحفاظ على حساسية عالية للأنسولين. توصف هذه الظاهرة بأنها “مفارقة الرياضي”8,9 ، ويتم تفسيرها من خلال تقييم أكثر دقة ل LDs العضلات ، المتعلقة بحجمها وكثافتها وتوطينها وديناميكياتها وتكوين أنواع الدهون.
أولا ، يرتبط حجم LD عكسيا بحساسية الأنسولين واللياقة البدنية10,11. في الواقع ، تظهر LDs الأصغر مساحة سطح أكبر نسبيا لعمل الليباز ، وبالتالي ، من المحتمل أن يكون لها قدرة أكبر على تعبئة الدهون12. ثانيا ، تلعب كثافة LD (العدد / السطح) دورا مثيرا للجدل في عمل الأنسولين 8,10 ؛ ومع ذلك ، يبدو أنه يزداد في الرياضيين. ثالثا ، يعد التوطين تحت الخلوي ل LDs مهما ، لأن LDs الموجودة أسفل الغشاء السطحي مباشرة (تحت الساركوليمال أو المحيطي) تمارس تأثيرا أكثر ضررا على حساسية الأنسولين من تلك المركزية 8,9,13. وتوفر هذه الأخيرة الوقود للميتوكوندريا المركزية، التي لديها نشاط تنفسي أكبر وأكثر تخصصا لتلبية الطلب المرتفع على الطاقة اللازم للانكماش14. وعلى النقيض من ذلك، توفر LDs الطرفية الميتوكوندريا تحت الساركوليمالية، التي تشارك في العمليات المتعلقة بالأغشية8. أخيرا ، بالإضافة إلى الدهون الثلاثية ، قد تكون الدهون المعقدة المحددة داخل العضلات أكثر ضررا من غيرها. على سبيل المثال ، قد يتراكم diacylglycerol و acyl-CoA طويل السلسلة والسيراميد في العضلات عندما يكون معدل دوران الدهون الثلاثية منخفضا ، مما يضعف إشارات الأنسولين 9,15. بالعودة إلى “مفارقة الرياضي” ، فإن رياضيي التحمل لديهم عدد كبير من LDs المركزية الأصغر حجما مع معدلات دوران مرتفعة في ألياف النوع الأول (المؤكسد) ، في حين أن مرضى السمنة والسكري لديهم LDs محيطية أكبر مع معدلات دوران منخفضة في ألياف النوع الثاني (السكري)8،15،16. بالإضافة إلى دورها في تخزين الطاقة وإطلاقها ، يمكن أن تعمل LDs عبر الأحماض الدهنية المشتقة (FA) وبروتين المعطف (perilipin 5) أيضا كلاعبين حاسمين يشاركون في التنظيم النسخي لأكسدة FA والتكوين الحيوي للميتوكوندريا8. بسبب آثارها الحاسمة في علم وظائف الأعضاء والفيزيولوجيا المرضية ، هناك ما يبرر إجراء دراسات متعمقة حول ديناميكيات ووظائف LDs.
على الرغم من وجود العديد من التقنيات لدراسة IMCLs ، إلا أنها ليست جميعها مناسبة لتحديد حجم LD وكثافته وتوزيعه بدقة بطريقة خاصة بالألياف. على سبيل المثال ، يوفر تقييم IMCLs بواسطة التحليل الطيفي بالرنين المغناطيسي ، على الرغم من كونه غير غازي ، مستوى من الدقة لا يكفي لدراسة حجم LDs وموقعها الدقيق داخل الألياف ، وليس من نوع الألياف المحدد17,18. وبالمثل ، لا يمكن للتقنيات الكيميائية الحيوية التي يتم إجراؤها على متجانسات العضلات بأكملها19 تقييم موقع وحجم الدهون. وبالتالي ، فإن الطريقة الأكثر ملاءمة لتحليل مورفولوجيا LD وموقعها هي المجهر الإلكتروني للإرسال الكمي13 ، ولكن هذه التقنية مكلفة وتستغرق وقتا طويلا. لذلك ، برز التصوير الفلوري البؤري على المستحضرات ذات الأصباغ مثل Oil Red O (ORO) 20,21 أو monodansylpentane (MDH)22 أو Bodipy 23,24,25 كأفضل أداة لهذه الدراسات.
هنا ، يتم وصف بروتوكول كامل ، بما في ذلك أخذ عينات الأنسجة ومعالجتها ، وتلطيخ Bodipy ، والحصول على الصور البؤرية وتحليلها لتحديد حجم LD وعددها وتوطينها في عمليات تبريد عضلات الفأر. نظرا لأن IMCLs لا يتم توزيعها بالتساوي بين الألياف المؤكسدة وتحلل السكر ، وينظم كل نوع من أنواع الألياف ديناميكيات LD بشكل مختلف ، يجب أن تكون دراسة IMCLs محددة من نوع الألياف 16,25,26,27. لذلك ، يستخدم هذا البروتوكول التألق المناعي على الأقسام التسلسلية لتحديد متساوي (أشكال) سلسلة الميوسين الثقيلة (MyHC) التي تعبر عنها كل ألياف. ميزة أخرى لهذا البروتوكول هي المعالجة المتزامنة ل glycolytic (الباسطة digitorum longus ، EDL) وعضلة مؤكسدة (وحيد) موضوعة جنبا إلى جنب قبل التجميد (الشكل 1). هذه المعالجة المتزامنة لا توفر الوقت فحسب ، بل تتجنب أيضا التباين بسبب المعالجة المنفصلة للعينات.
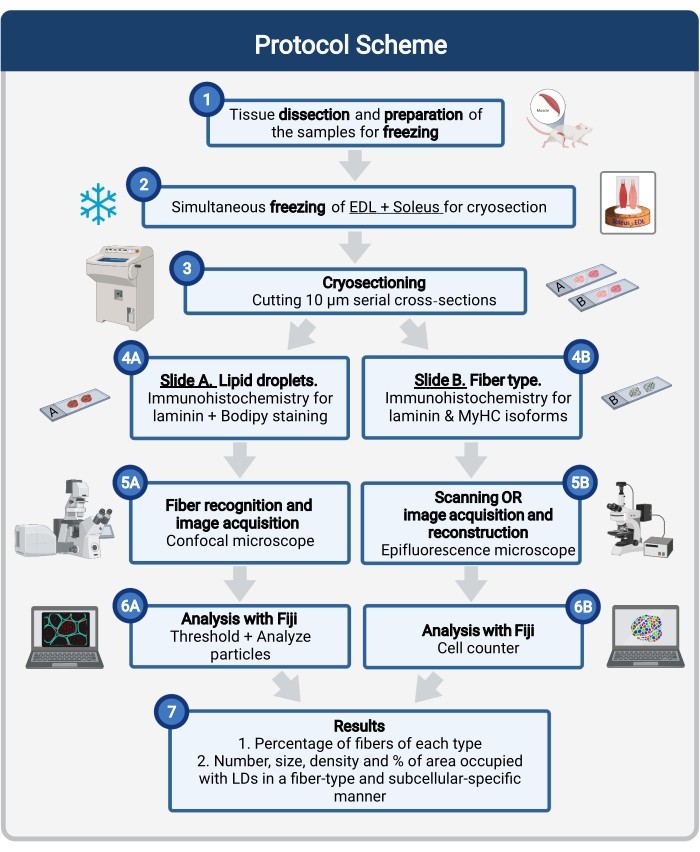
الشكل 1: نظرة عامة تخطيطية على الإجراء. بعد تشريح العضلات (1) ، يتم تحضير العضلات المختارة ذات الحجم المماثل وتجميدها معا (2). يتم الحصول على مقاطع عرضية تسلسلية من 10 ميكرومتر باستخدام cryostat ومثبتة مباشرة على شرائح الالتصاق (3). من شريحتين تسلسليتين ، الأولى (4A) مناعية للأمينين وملطخة ب Bodipy للتعرف على LDs والثانية (4B) ملطخة بالمناعة بالأجسام المضادة ضد MyHCs للتعرف على أنواع الألياف العضلية. يتم الحصول على الصور باستخدام مجهر متحد البؤرة ل Bodipy (5A) ومجهر epifluorescence لأنواع ألياف العضلات (5B). يتم تحليل الصور في فيجي من خلال تطبيق عتبة وتحديد كمية الجسيمات (6A) للحصول على العدد ومتوسط الحجم والكثافة والنسبة المئوية من المساحة الإجمالية التي تشغلها LDs (7) أو خلايا العد (6B) للحصول على النسبة المئوية للألياف من كل نوع في القسم (7). الاختصارات: LDs = قطرات الدهون. EDL = الباسطة الرقمية طويلة ؛ MyHCs = الميوسين سلسلة متساوية الثقيلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
يصف البروتوكول المفصل هنا طريقة فعالة لقياس LDs الموسومة ب Bodipy على أساس نوع الألياف وتحت الخلوية. في السنوات الأخيرة ، تم استبدال الأصباغ الدهنية الكلاسيكية ، مثل ORO أو Sudan Black B ، بمجموعة جديدة من الأصباغ الفلورية النفاذة للخلايا والمحبة للدهون التي ترتبط بالدهون المحايدة (على سبيل المثال ، …
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من خلال منح من الصندوق الوطني للبحوث العلمية (FNRS-Crédit de Recherche J.0022.20) والشركة الفرنكوفونية لديابيت (SFD-Roche Diabetes Care).C.M.S. حاصل على زمالة الدكتوراه من FRIA (FNRS). حصل M.A.D.-L.d.C. على زمالة من برنامج Wallonie-Bruxelles الدولي للتميز.
يشكر المؤلفون أليس مونييه على مساهمتها في تطوير هذا البروتوكول وكارولين بوزين على خبرتها ومساعدتها التقنية في عملية الحصول على الصور. كما نشكر منصة التصوير 2IP-IREC للوصول إلى المجهر والمجاهر (منصة التصوير 2IP-IREC ، معهد البحوث التجريبية والسريرية ، الجامعة الكاثوليكية في لوفان ، 1200 بروكسل ، بلجيكا). وأخيرا، يود المؤلفون أن يشكروا نيكولاس دوبويسون ورومان فيرسيل وميشيل أبو سمرة على النقد البناء للمخطوطة. تم إنشاء بعض أرقام هذه المقالة مع BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

