Tipo di fibra e analisi subcellulare specifica del contenuto di goccioline lipidiche nel muscolo scheletrico
Summary
Prove crescenti indicano che l’eccessiva infiltrazione di lipidi all’interno del muscolo scheletrico provoca lipotossicità e diabete. Qui, presentiamo un protocollo completo, che include l’elaborazione dei tessuti, la colorazione con Bodipy, l’acquisizione di immagini e l’analisi, per quantificare le dimensioni, la densità e la distribuzione subcellulare delle goccioline lipidiche in un modo specifico per il tipo di fibra.
Abstract
L’infiltrazione lipidica del muscolo scheletrico, nota come miosteatosi, aumenta con l’obesità e l’invecchiamento. La miosteatosi è stata anche recentemente scoperta come fattore prognostico negativo per molti altri disturbi come le malattie cardiovascolari e il cancro. L’eccessiva infiltrazione lipidica diminuisce la massa muscolare e la forza. Si traduce anche in lipotossicità e insulino-resistenza a seconda del contenuto lipidico intramiocellulare totale, della morfologia delle goccioline lipidiche (LD) e della distribuzione subcellulare. Anche il tipo di fibra (ossidativo vs glicolitico) è importante, poiché le fibre ossidative hanno una maggiore capacità di utilizzare i lipidi. A causa delle loro implicazioni cruciali in fisiopatologia, sono giustificati studi approfonditi sulla dinamica e la funzione della LD in un modo specifico per tipo di fibra.
Qui viene presentato un protocollo completo per la quantificazione del contenuto lipidico intramiocellulare e l’analisi della morfologia della LD e della distribuzione subcellulare in modo specifico per tipo di fibra. A tal fine, le criosezioni muscolari seriali sono state colorate con il colorante fluorescente Bodipy e anticorpi contro le isoforme a catena pesante della miosina. Questo protocollo consente l’elaborazione simultanea di diversi muscoli, risparmiando tempo ed evitando possibili artefatti e, grazie a una macro personalizzata creata nelle Fiji, è anche possibile l’automatizzazione dell’analisi LD.
Introduction
L’infiltrazione lipidica del muscolo scheletrico, nota come miosteatosi, aumenta con l’obesità e l’invecchiamento. La miosteatosi è correlata negativamente con la massa e la forza muscolare e con la sensibilità all’insulina1. Inoltre, studi recenti indicano che il grado di miosteatosi potrebbe essere utilizzato come fattore prognostico per altre condizioni come la malattia cardiovascolare2, la steatosi epatica non alcolica3 o il cancro4. I lipidi possono accumularsi nel muscolo scheletrico tra le fibre muscolari come lipidi extramiocellulari o all’interno delle fibre, come lipidi intramiocellulari (IMCL). Gli IMCL sono prevalentemente immagazzinati come trigliceridi in goccioline lipidiche (LD) che vengono utilizzate come combustibile metabolico durante l’esercizio fisico 5,6. Tuttavia, quando l’offerta lipidica supera la domanda, o quando i mitocondri diventano disfunzionali, gli IMCL saranno implicati nella resistenza all’insulina muscolare, come si vede in individui metabolicamente malsani e obesi e nei pazienti con diabete di tipo 27. Curiosamente, gli atleti di resistenza hanno livelli simili, se non più alti, di IMCL a quelli trovati nei pazienti obesi con diabete mellito di tipo 2, pur mantenendo un’elevata sensibilità all’insulina. Questo fenomeno è descritto come il “paradosso dell’atleta”8,9, ed è spiegato da una valutazione più sfumata degli LCD muscolari, relativi alle loro dimensioni, densità, localizzazione, dinamica e composizione delle specie lipidiche.
In primo luogo, la dimensione della LD è inversamente correlata alla sensibilità all’insulina e alla forma fisica10,11. In effetti, le LD più piccole mostrano una superficie relativamente maggiore per l’azione della lipasi e, quindi, potenzialmente hanno una maggiore capacità di mobilitare i lipidi12. In secondo luogo, la densità LD (numero/superficie) svolge un ruolo controverso nell’azione dell’insulina 8,10; tuttavia, sembra essere aumentato negli atleti. In terzo luogo, la localizzazione subcellulare delle LD è importante, poiché le LD situate appena sotto la membrana superficiale (subsarcolemmale o periferica) esercitano un effetto più deleterio sulla sensibilità all’insulina rispetto a quelle centrali 8,9,13. Questi ultimi forniscono carburante ai mitocondri centrali, che hanno una maggiore attività respiratoria e sono più specializzati per soddisfare l’elevata domanda di energia richiesta per la contrazione14. Al contrario, le LD periferiche forniscono mitocondri subsarcolemmali, che sono coinvolti nei processi correlati alla membrana8. Infine, oltre ai trigliceridi, specifici lipidi complessi all’interno del muscolo possono essere più deleteri di altri. Ad esempio, il diacilglicerolo, l’acil-CoA a catena lunga e le ceramidi possono accumularsi nel muscolo quando il tasso di turnover dei trigliceridi è basso, compromettendo così la segnalazione dell’insulina 9,15. Tornando al “paradosso dell’atleta”, gli atleti di resistenza hanno un numero elevato di LD centrali più piccoli con elevati tassi di turnover nelle fibre di tipo I (ossidative), mentre i pazienti obesi e diabetici hanno LD periferici più grandi con bassi tassi di turnover nelle fibre di tipo II (glicolitiche) 8,15,16. Oltre al loro ruolo nell’immagazzinamento e nel rilascio di energia, gli LCD tramite acidi grassi derivati (FA) e una proteina del mantello (perilipina 5) potrebbero anche funzionare come attori critici coinvolti nella regolazione trascrizionale dell’ossidazione fa e della biogenesi mitocondriale8. A causa delle loro implicazioni cruciali in fisiologia e fisiopatologia, sono giustificati studi approfonditi sulla dinamica e le funzioni dei LD.
Sebbene esistano diverse tecniche per studiare le IMCL, non sono tutte adatte a quantificare con precisione le dimensioni, la densità e la distribuzione dei LD in modo specifico per le fibre. Ad esempio, la valutazione delle IMCL mediante spettroscopia di risonanza magnetica, pur essendo non invasiva, offre un livello di risoluzione che non è sufficiente per studiare le dimensioni e la posizione precisa degli LCD all’interno della fibra, e non è specifico per il tipo di fibra17,18. Allo stesso modo, le tecniche biochimiche eseguite su omogeneizzati muscolari interi19 non possono valutare la posizione e le dimensioni dei lipidi. Di conseguenza, il metodo più adeguato per analizzare la morfologia e la posizione della LD è la microscopia elettronica a trasmissione quantitativa13, ma questa tecnica è costosa e richiede tempo. Pertanto, l’imaging a fluorescenza confocale su preparati con coloranti come Oil Red O (ORO)20,21, monodansylpentane (MDH)22 o Bodipy 23,24,25, è emerso come lo strumento migliore per questi studi.
Qui viene descritto un protocollo completo, che include il campionamento e l’elaborazione dei tessuti, la colorazione di Bodipy e l’acquisizione e l’analisi di immagini confocali per quantificare le dimensioni, il numero e la localizzazione di LD nelle criosezioni muscolari del topo. Poiché gli IMCL non sono distribuiti uniformemente tra fibre ossidative e glicolitiche e ogni tipo di fibra regola la dinamica LD in modo diverso, lo studio delle IMML deve essere specifico per il tipo di fibra 16,25,26,27. Pertanto, questo protocollo utilizza l’immunofluorescenza su sezioni seriali per identificare le isoforme a catena pesante della miosina (MyHC) espresse da ciascuna fibra. Un altro vantaggio di questo protocollo è l’elaborazione simultanea di un muscolo glicolitico (estensore digitorum longus, EDL) e di un muscolo ossidativo (soleo) posti fianco a fianco prima del congelamento (Figura 1). Questa elaborazione simultanea non solo consente di risparmiare tempo, ma evita anche la variabilità dovuta all’elaborazione separata dei campioni.
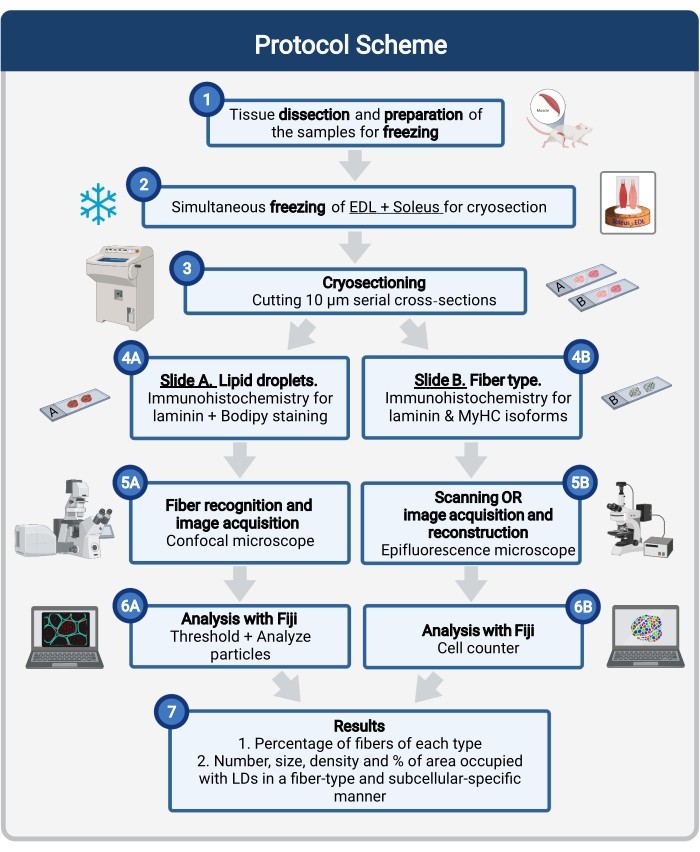
Figura 1: Panoramica schematica della procedura. Dopo la dissezione muscolare (1), i muscoli selezionati di dimensioni simili vengono preparati e congelati insieme (2). Le sezioni trasversali seriali di 10 μm sono ottenute utilizzando un criostato e montate direttamente su vetrini di adesione (3). Da due vetrini seriali, il primo (4A) è immunomarcato per la laminina e colorato con Bodipy per riconoscere gli LD e il secondo (4B) è immunocolorato con anticorpi contro i MyHC per il riconoscimento dei tipi di fibre muscolari. Le immagini vengono acquisite utilizzando un microscopio confocale per Bodipy (5A) e un microscopio a epifluorescenza per i tipi di fibre muscolari (5B). Le immagini vengono analizzate nelle Figi applicando una soglia e quantificando le particelle (6A) per ottenere il numero, la dimensione media, la densità e la percentuale dell’area totale occupata da LD (7) o celle di conteggio (6B) per ottenere la percentuale di fibre di ciascun tipo nella sezione (7). Abbreviazioni: LDs = goccioline lipidiche; EDL = estensore digitorum longus; MyHC = isoforme a catena pesante della miosina. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo qui dettagliato descrive un metodo efficiente per quantificare gli LD etichettati con Bodipy su una base specifica per tipo di fibra e subcellulare. Negli ultimi anni, i coloranti lipidici classici, come ORO o Sudan Black B, sono stati sostituiti con una nuova serie di coloranti fluorescenti permeabili alle cellule, lipofili e che si legano ai lipidi neutri (ad esempio, Bodipy). Disponibile come diversi coniugati, Bodipy si è dimostrato molto efficace nel taggare gli LD per studiare la loro morfologia, din…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto da sovvenzioni del Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) e della Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. è il destinatario di una borsa di dottorato dalla FRIA (FNRS). M.A.D.-L.d.C. ha ricevuto una borsa di studio dal Wallonie-Bruxelles International Excellence Program.
Gli autori ringraziano Alice Monnier per il suo contributo allo sviluppo di questo protocollo e Caroline Bouzin per la sua esperienza e l’aiuto tecnico nel processo di acquisizione delle immagini. Ringraziamo anche la piattaforma di imaging 2IP-IREC per l’accesso al criostato e ai microscopi (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Bruxelles, Belgio). Infine, gli autori desiderano ringraziare Nicolas Dubuisson, Romain Versele e Michel Abou-Samra per la critica costruttiva del manoscritto. Alcune delle figure di questo articolo sono state create con BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

