Fibertype og subcellulær-specifik analyse af lipiddråbeindhold i skeletmuskulatur
Summary
Stigende beviser tyder på, at overdreven infiltration af lipider inde i skeletmuskulaturen resulterer i lipotoksicitet og diabetes. Her præsenterer vi en komplet protokol, herunder vævsbehandling, farvning med Bodipy, billedoptagelse og analyse, for at kvantificere størrelsen, densiteten og den subcellulære fordeling af lipiddråber på en fibertypespecifik måde.
Abstract
Skeletmuskel lipid infiltration, kendt som myosteatose, stiger med fedme og aldring. Myosteatose er også for nylig blevet opdaget som en negativ prognostisk faktor for flere andre lidelser såsom hjerte-kar-sygdomme og kræft. Overdreven lipidinfiltration nedsætter muskelmasse og styrke. Det resulterer også i lipotoksicitet og insulinresistens afhængigt af total intramyocellulært lipidindhold, lipiddråbe (LD) morfologi og subcellulær fordeling. Fibertype (oxidativ vs glykolytisk) er også vigtig, da oxidative fibre har større kapacitet til at udnytte lipider. På grund af deres afgørende implikationer i patofysiologi er dybtgående undersøgelser af LD-dynamik og funktion på en fibertypespecifik måde berettiget.
Heri præsenteres en komplet protokol til kvantificering af intramyocellulært lipidindhold og analyse af LD-morfologi og subcellulær fordeling på en fibertypespecifik måde. Til dette formål blev serielle muskelkryosektioner farvet med det fluorescerende farvestof Bodipy og antistoffer mod myosin tunge kædeisoformer. Denne protokol muliggør samtidig behandling af forskellige muskler, hvilket sparer tid og undgår mulige artefakter, og takket være en personlig makro oprettet i Fiji er automatisering af LD-analyse også mulig.
Introduction
Skeletmuskel lipid infiltration, kendt som myosteatose, stiger med fedme og aldring. Myosteatose er negativt korreleret med muskelmasse og styrke og med insulinfølsomhed1. Desuden viser nylige undersøgelser, at graden af myosteatose kan anvendes som en prognostisk faktor for andre tilstande såsom hjerte-kar-sygdom2, ikke-alkoholisk fedtleversygdom3 eller kræft4. Lipider kan akkumuleres i skeletmuskulatur mellem muskelfibre som ekstramyocellulære lipider eller i fibrene, som intramyocellulære lipider (IMCLs). IMCL’er opbevares overvejende som triglycerider i lipiddråber (LD’er), der anvendes som metabolisk brændstof under fysisk træning 5,6. Men når lipidforsyningen overstiger efterspørgslen, eller når mitokondrier bliver dysfunktionelle, vil IMCLs være impliceret i muskelinsulinresistens, som det ses hos metabolisk usunde, overvægtige individer og hos type 2-diabetespatienter7. Spændende nok har udholdenhedsatleter lignende, hvis ikke højere, niveauer af IMCLs til dem, der findes hos overvægtige patienter med type 2-diabetes mellitus, samtidig med at de opretholder høj insulinfølsomhed. Dette fænomen beskrives som “atletens paradoks”8,9 og forklares ved en mere nuanceret vurdering af muskel-ID’er relateret til deres størrelse, tæthed, lokalisering, dynamik og lipidartssammensætning.
For det første er LD-størrelse omvendt korreleret med insulinfølsomhed og fysisk kondition10,11. Faktisk udviser mindre LD’er et relativt større overfladeareal til lipasevirkning og har således potentielt en større kapacitet til at mobilisere lipider12. For det andet spiller LD-densitet (tal/overflade) en kontroversiel rolle i insulinvirkning 8,10; alligevel ser det ud til at være øget hos atleter. For det tredje er den subcellulære lokalisering af LD’er vigtig, da LD’er placeret lige under overflademembranen (subsarcolemmal eller perifer) udøver en mere skadelig virkning på insulinfølsomheden end centrale 8,9,13. Sidstnævnte giver brændstof til centrale mitokondrier, som har en større respiratorisk aktivitet og er mere specialiserede til at imødekomme det høje energibehov, der kræves til sammentrækning14. I modsætning hertil leverer perifere LD’er subsarcolemmale mitokondrier, som er involveret i membranrelaterede processer8. Endelig, ud over triglycerider, kan specifikke komplekse lipider i musklen være mere skadelige end andre. For eksempel kan diacylglycerol, langkædet acyl-CoA og ceramider akkumulere i muskler, når triglyceridomsætningshastigheden er lav, hvilket forringer insulinsignalering 9,15. For at vende tilbage til “atletens paradoks” har udholdenhedsatleter et stort antal mindre centrale LD’er med forhøjede omsætningshastigheder i type I (oxidative) fibre, mens overvægtige og diabetespatienter har større perifere LD’er med lave omsætningshastigheder i type II (glykolytiske) fibre 8,15,16. Ud over deres rolle i energilagring og frigivelse kunne LD’er via afledte fedtsyrer (FA) og et pelsprotein (perilipin 5) også fungere som kritiske aktører involveret i transkriptionel regulering af FA-oxidation og mitokondriebiogenese8. På grund af deres afgørende implikationer i fysiologi og patofysiologi er dybtgående undersøgelser af LD’ers dynamik og funktioner berettiget.
Selvom der er flere teknikker til at studere IMCL’er, er de ikke alle egnede til nøjagtigt at kvantificere LD-størrelse, densitet og distribution på en fiberspecifik måde. For eksempel tilbyder vurderingen af IMCLs ved magnetisk resonansspektroskopi, selvom den ikke er invasiv, et opløsningsniveau, der ikke er tilstrækkeligt til at studere størrelsen og den præcise placering af LD’er i fiberen, og det er ikke fibertypespecifikt17,18. Ligeledes kan biokemiske teknikker udført på helmuskelhomogenater19 ikke vurdere placeringen og størrelsen af lipider. Følgelig er den mest passende metode til analyse af LD-morfologi og placering kvantitativ transmissionselektronisk mikroskopi13, men denne teknik er dyr og tidskrævende. Derfor har konfokal fluorescensbilleddannelse på præparater med farvestoffer som Oil Red O (ORO)20,21, monodansylpentan (MDH)22 eller Bodipy 23,24,25 vist sig som det bedste værktøj til disse undersøgelser.
Her beskrives en komplet protokol, herunder vævsprøvetagning og -behandling, Bodipy-farvning og konfokal billedoptagelse og analyse for at kvantificere LD-størrelse, antal og lokalisering i musemuskelkryosektioner. Da IMCL’er ikke er jævnt fordelt mellem oxidative og glykolytiske fibre, og hver fibertype regulerer LD-dynamik forskelligt, skal undersøgelsen af IMCLs være fibertypespecifik 16,25,26,27. Derfor bruger denne protokol immunfluorescens på serielle sektioner til at identificere myosin tung kæde (MyHC) isoform (er) udtrykt af hver fiber. En anden fordel ved denne protokol er samtidig behandling af en glykolytisk (extensor digitorum longus, EDL) og en oxidativ (soleus) muskel placeret side om side før frysning (figur 1). Denne samtidige behandling sparer ikke kun tid, men undgår også variabilitet på grund af separat behandling af prøverne.
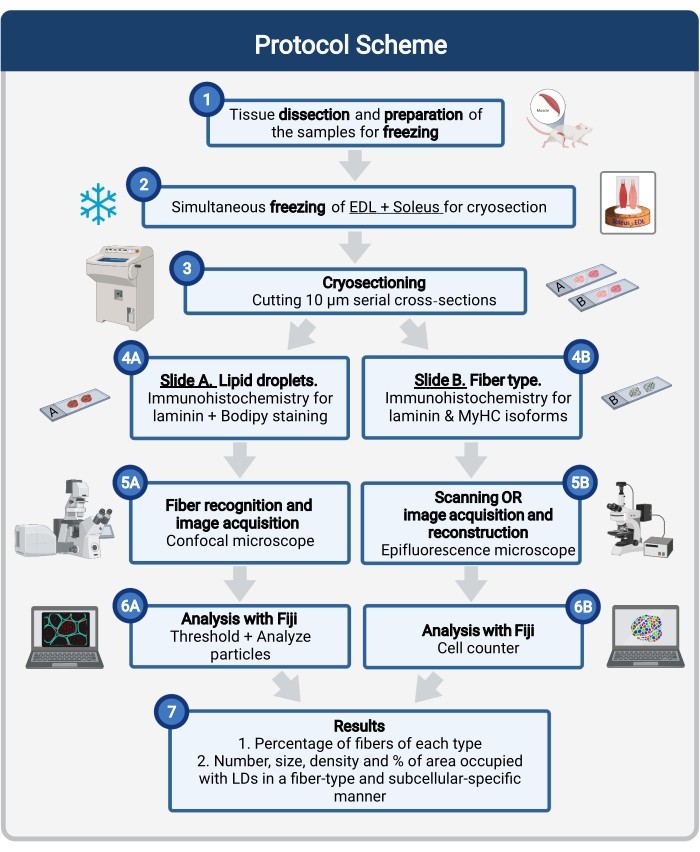
Figur 1: Skematisk oversigt over proceduren. Efter muskeldissektion (1) fremstilles udvalgte muskler af samme størrelse og fryses sammen (2). Serielle tværgående sektioner på 10 μm opnås ved anvendelse af en kryostat og monteres direkte på adhæsionsglas (3). Fra to serielle dias er den første (4A) immunmærket for laminin og farvet med Bodipy for at genkende LD’er, og den anden (4B) er immunostained med antistoffer mod MyHC’er til genkendelse af muskelfibertyper. Billeder erhverves ved hjælp af et konfokalt mikroskop til Bodipy (5A) og et epifluorescensmikroskop til muskelfibertyper (5B). Billeder analyseres i Fiji ved at anvende en tærskel og kvantificere partikler (6A) for at opnå antallet, gennemsnitsstørrelsen, densiteten og procentdelen af det samlede areal, der er optaget af LD’er (7) eller tælleceller (6B) for at opnå procentdelen af fibre af hver type i sektionen (7). Forkortelser: LD’er = lipiddråber; EDL = extensor digitorum longus; MyHC’er = myosin tunge kæde isoformer. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Protokollen, der er beskrevet her, beskriver en effektiv metode til at kvantificere LD’er mærket med Bodipy på fibertype- og subcellulært-specifikt grundlag. I de senere år er klassiske lipidfarvestoffer, såsom ORO eller Sudan Black B, blevet erstattet med et nyt udvalg af cellegennemtrængelige, lipofile, fluorescerende farvestoffer, der binder til neutrale lipider (f.eks. Bodipy). Bodipy fås som forskellige konjugater og har vist sig meget effektiv til at mærke LD’er for at studere deres morfologi, dynamik og in…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af tilskud fra Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) og Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. er modtager af et ph.d.-stipendium fra FRIA (FNRS). M.A.D.-L.d.C. modtog et stipendium fra Wallonie-Bruxelles International Excellence Program.
Forfatterne takker Alice Monnier for hendes bidrag til udviklingen af denne protokol og Caroline Bouzin for hendes ekspertise og tekniske hjælp i billedoptagelsesprocessen. Vi takker også 2IP-IREC-billeddannelsesplatformen for adgang til kryostaten og mikroskoperne (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Bruxelles, Belgien). Endelig vil forfatterne gerne takke Nicolas Dubuisson, Romain Versele og Michel Abou-Samra for konstruktiv kritik af manuskriptet. Nogle af figurerne i denne artikel blev oprettet med BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

