Fibertyp och subcellulär-specifik analys av lipiddroppinnehåll i skelettmuskulaturen
Summary
Ökande bevis tyder på att överdriven infiltration av lipider inuti skelettmuskulaturen resulterar i lipotoxicitet och diabetes. Här presenterar vi ett komplett protokoll, inklusive vävnadsbehandling, färgning med Bodipy, bildförvärv och analys, för att kvantifiera storleken, densiteten och subcellulär fördelning av lipiddroppar på ett fibertypspecifikt sätt.
Abstract
Skelettmuskellipidinfiltration, känd som myosteatos, ökar med fetma och åldrande. Myosteatos har också nyligen upptäckts som en negativ prognostisk faktor för flera andra sjukdomar som hjärt-kärlsjukdom och cancer. Överdriven lipidinfiltration minskar muskelmassa och styrka. Det resulterar också i lipotoxicitet och insulinresistens beroende på totalt intramyocellulärt lipidinnehåll, lipiddroppe (LD) morfologi och subcellulär distribution. Fibertyp (oxidativ vs glykolytisk) är också viktig, eftersom oxidativa fibrer har större kapacitet att utnyttja lipider. På grund av deras avgörande konsekvenser inom patofysiologi är fördjupade studier av LD-dynamik och funktion på ett fibertypspecifikt sätt motiverade.
Häri presenteras ett komplett protokoll för kvantifiering av intramyocellulärt lipidinnehåll och analys av LD-morfologi och subcellulär distribution på ett fibertypspecifikt sätt. För detta ändamål färgades seriella muskelkryosektioner med det fluorescerande färgämnet Bodipy och antikroppar mot myosin tunga kedjeisoformer. Detta protokoll möjliggör samtidig bearbetning av olika muskler, vilket sparar tid och undviker möjliga artefakter och tack vare ett personligt makro skapat i Fiji är automatiseringen av LD-analys också möjlig.
Introduction
Skelettmuskellipidinfiltration, känd som myosteatos, ökar med fetma och åldrande. Myosteatos är negativt korrelerad med muskelmassa och styrka och med insulinkänslighet1. Dessutom tyder nya studier på att graden av myosteatos kan användas som en prognostisk faktor för andra tillstånd som hjärt-kärlsjukdom2, alkoholfri fettleversjukdom3 eller cancer4. Lipider kan ackumuleras i skelettmuskulaturen mellan muskelfibrer som extramyocellulära lipider eller i fibrerna, som intramyocellulära lipider (IMCLs). IMCLs lagras främst som triglycerider i lipiddroppar (LDs) som används som metaboliskt bränsle under fysisk träning 5,6. Men när lipidutbudet överstiger efterfrågan, eller när mitokondrier blir dysfunktionella, kommer IMCLs att vara inblandade i muskelinsulinresistens, vilket ses hos metaboliskt ohälsosamma, överviktiga individer och hos typ 2-diabetespatienter7. Intressant nog har uthållighetsidrottare liknande, om inte högre, nivåer av IMCLs som de som finns hos överviktiga patienter med typ 2-diabetes mellitus, samtidigt som de bibehåller hög insulinkänslighet. Detta fenomen beskrivs som “idrottarens paradox”8,9 och förklaras av en mer nyanserad bedömning av muskel-LDs, relaterade till deras storlek, densitet, lokalisering, dynamik och lipidartsammansättning.
För det första är LD-storlek omvänt korrelerad till insulinkänslighet och fysisk kondition10,11. Faktum är att mindre LD uppvisar en relativt större ytarea för lipasverkan och därmed potentiellt har en större kapacitet att mobilisera lipider12. För det andra spelar LD-densitet (antal / yta) en kontroversiell roll i insulinverkan 8,10; ändå verkar det ökas hos idrottare. För det tredje är den subcellulära lokaliseringen av LDs viktig, eftersom LDs som ligger strax under ytmembranet (subsarcolemmal eller perifer) utövar en mer skadlig effekt på insulinkänsligheten än centrala 8,9,13. De senare ger bränsle till centrala mitokondrier, som har en större andningsaktivitet och är mer specialiserade för att möta det höga energibehovet som krävs för sammandragning14. Däremot levererar perifera LDs subsarcolemmal mitokondrier, som är involverade i membranrelaterade processer8. Slutligen, utöver triglycerider, kan specifika komplexa lipider i muskeln vara mer skadliga än andra. Till exempel kan diacylglycerol, långkedjig acyl-CoA och ceramider ackumuleras i muskler när triglyceridomsättningshastigheten är låg, vilket försämrar insulinsignalering 9,15. För att återgå till “idrottarens paradox” har uthållighetsidrottare ett stort antal mindre centrala LDs med förhöjda omsättningshastigheter i typ I (oxidativa) fibrer, medan överviktiga och diabetespatienter har större perifera LDs med låg omsättningshastighet i typ II (glykolytiska) fibrer 8,15,16. Förutom sin roll i energilagring och frisättning kan LDs via härledda fettsyror (FA) och ett pälsprotein (perilipin 5) också fungera som kritiska aktörer som är involverade i transkriptionell reglering av FA-oxidation och mitokondriell biogenes8. På grund av deras avgörande konsekvenser inom fysiologi och patofysiologi är fördjupade studier av LDs dynamik och funktioner motiverade.
Även om det finns flera tekniker för att studera IMCLs, är de inte alla lämpliga för att exakt kvantifiera LD-storlek, densitet och distribution på ett fiberspecifikt sätt. Till exempel erbjuder bedömningen av IMCLs genom magnetisk resonansspektroskopi, även om den är icke-invasiv, en upplösningsnivå som inte är tillräcklig för att studera storleken och den exakta placeringen av LD: er i fibern, och det är inte fibertypsspecifikt17,18. På samma sätt kan biokemiska tekniker som utförs på helmuskelhomogenater19 inte bedöma placeringen och storleken på lipider. Följaktligen är den mest adekvata metoden för att analysera LD-morfologi och plats kvantitativ överföring elektronisk mikroskopi13, men denna teknik är dyr och tidskrävande. Därför har konfokal fluorescensavbildning på preparat med färgämnen som Oil Red O (ORO)20,21, monodansylpentan (MDH)22 eller Bodipy 23,24,25 framstått som det bästa verktyget för dessa studier.
Här beskrivs ett komplett protokoll, inklusive vävnadsprovtagning och bearbetning, Bodipy-färgning och konfokal bildförvärv och analys för att kvantifiera LD-storlek, antal och lokalisering i musmuskelkryosektioner. Eftersom IMCLs inte är jämnt fördelade mellan oxidativa och glykolytiska fibrer, och varje fibertyp reglerar LD-dynamiken annorlunda, måste studien av IMCLs vara fibertypspecifik 16,25,26,27. Därför använder detta protokoll immunofluorescens på seriella sektioner för att identifiera myosin tunga kedjor (MyHC) isoform (er) uttryckt av varje fiber. En annan fördel med detta protokoll är samtidig behandling av en glykolytisk (extensor digitorum longus, EDL) och en oxidativ (soleus) muskel placerad sida vid sida före frysning (Figur 1). Denna samtidiga bearbetning sparar inte bara tid utan undviker också variabilitet på grund av separat bearbetning av proverna.
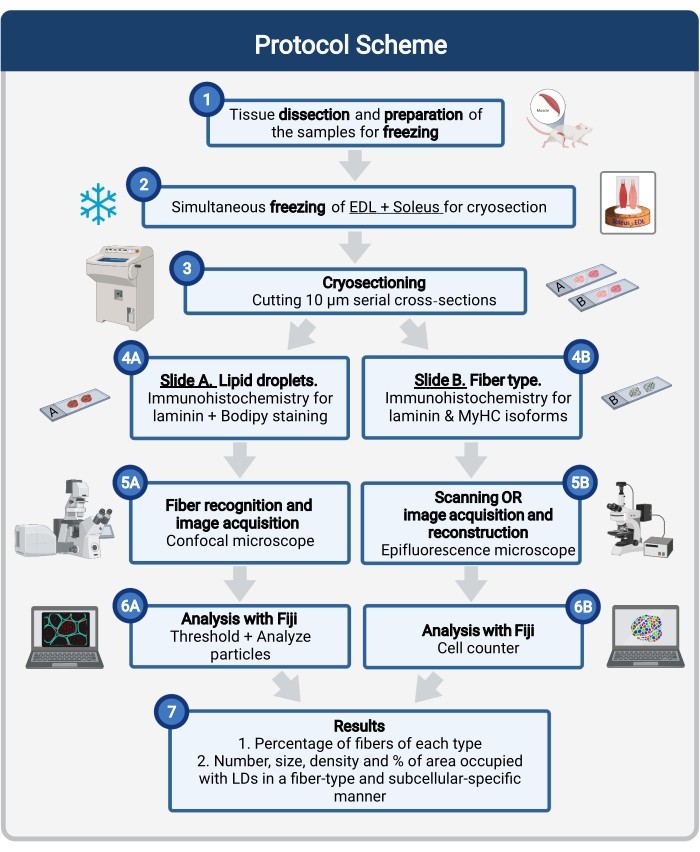
Figur 1: Schematisk översikt över proceduren. Efter muskeldissektion (1) förbereds och fryses utvalda muskler av liknande storlek (2). Seriella tvärsektioner på 10 μm erhålls med användning av en kryostat och monteras direkt på vidhäftningsglas (3). Från två seriella bilder är den första (4A) immunolabelerad för laminin och färgad med Bodipy för att känna igen LDs och den andra (4B) immunostained med antikroppar mot MyHC för erkännande av muskelfibertyper. Bilder förvärvas med hjälp av ett konfokalmikroskop för Bodipy (5A) och ett epifluorescensmikroskop för muskelfibertyper (5B). Bilder analyseras i Fiji genom att tillämpa en tröskel och kvantifiera partiklar (6A) för att erhålla antalet, medelstorleken, densiteten och procentandelen av den totala ytan som upptas av LDs (7) eller räkningsceller (6B) för att erhålla procentandelen fibrer av varje typ i sektionen (7). Förkortningar: LDs = lipiddroppar; EDL = extensor digitorum longus; MyHC = myosin tunga kedjeisoformer. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Protokollet som beskrivs här beskriver en effektiv metod för att kvantifiera LD: er märkta med Bodipy på en fibertyp- och subcellulär specifik basis. Under de senaste åren har klassiska lipidfärger, såsom ORO eller Sudan Black B, ersatts med en ny uppsättning cellgenomsläppliga, lipofila, fluorescerande färgämnen som binder till neutrala lipider (t.ex. Bodipy). Bodipy finns som olika konjugat och har visat sig vara mycket effektivt för att märka LDs för att studera deras morfologi, dynamik och interaktion …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av bidrag från Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) och Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. är mottagare av ett doktorandstipendium från FRIA (FNRS). M.A.D.-L.d.C. fick ett stipendium från Wallonie-Bruxelles International Excellence Program.
Författarna tackar Alice Monnier för hennes bidrag till utvecklingen av detta protokoll och Caroline Bouzin för hennes expertis och tekniska hjälp i bildförvärvsprocessen. Vi tackar också 2IP-IREC-bildplattformen för tillgång till kryostaten och mikroskopen (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Bryssel, Belgien). Slutligen vill författarna tacka Nicolas Dubuisson, Romain Versele och Michel Abou-Samra för konstruktiv kritik av manuskriptet. Några av figurerna i denna artikel skapades med BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
References
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

