טכניקות מיקרוסקופיה לפענוח התיישבות פטרייתית ברקמות צמחים מיקוהטרוטרופיים ונביטה סימביוטית של זרעים
Summary
פרוטוקול זה נועד לספק נהלים מפורטים לאיסוף, תיקון ותחזוקה של דגימות צמחים מיקוהטרוטרופיים, תוך יישום טכניקות מיקרוסקופיה שונות כגון מיקרוסקופיית אלקטרונים סורקת והולכה, מיקרוסקופיית אור, קונפוקלית ופלואורסצנטית כדי לחקור התיישבות פטרייתית ברקמות צמחים ובזרעים שנבטו בפטריות מיקוריזאליות.
Abstract
בוטניקה מבנית היא נקודת מבט חיונית להבנה מלאה של האקולוגיה, הפיזיולוגיה, ההתפתחות והאבולוציה של צמחים. כאשר חוקרים צמחים מיקוהטרוטרופיים (כלומר, צמחים המקבלים פחמן מפטריות), היבטים יוצאי דופן של ההסתגלות המבנית שלהם, דפוסי התיישבות הרקמות על ידי פטריות והמורפואאנטומיה של איברים תת-קרקעיים יכולים להאיר את אסטרטגיות ההתפתחות שלהם ואת הקשרים שלהם עם hyphae, המקור של חומרים מזינים. תפקיד חשוב נוסף של פטריות סימביוטיות קשור לנביטת זרעי סחלב; כל מיני הסחלבים הם מיקוהטרוטרופיים בשלב הנביטה והשתילים (מיקוהטרוטרופיה ראשונית), אפילו אלה שמבצעים פוטוסינתזה בשלבים בוגרים. בשל היעדר עתודות תזונתיות בזרעי סחלב, סימביונטים פטרייתיים חיוניים כדי לספק מצעים ולאפשר נביטה. ניתוח שלבי הנביטה על ידי פרספקטיבות מבניות יכול גם לענות על שאלות חשובות לגבי האינטראקציה של הפטריות עם הזרעים. ניתן ליישם טכניקות הדמיה שונות כדי לחשוף אנדופיטים של פטריות ברקמות צמחים, כפי שמוצע במאמר זה. ניתן להכתים חלקים חופשיים ודקים של איברי הצמח ואז לצפות בהם באמצעות מיקרוסקופיה קלה. פלואורוכרום המצומד לאגלוטינין של נבט חיטה יכול להיות מיושם על הפטריות ולדגור יחד עם Calcofluor White כדי להדגיש את דפנות תאי הצמח במיקרוסקופיה קונפוקלית. בנוסף, המתודולוגיות של מיקרוסקופיית אלקטרונים סריקה והעברה מפורטות עבור סחלבים מיקוהטרוטרופיים, ונבחנות האפשרויות ליישם פרוטוקולים כאלה בצמחים קשורים. נביטה סימביוטית של זרעי סחלב (כלומר, בנוכחות פטריות מיקוריזאליות) מתוארת בפרוטוקול בפירוט, יחד עם אפשרויות להכנת המבנים המתקבלים משלבי נביטה שונים לניתוחים עם אור, קונפוקל ומיקרוסקופיית אלקטרונים.
Introduction
מחקר מבני בבוטניקה, המכסה מורפולוגיה ואנטומיה של צמחים, הוא בסיסי בהבנת האורגניזםכולו 1,2, ומספק נקודות מבט חיוניות לשילוב ותרומה לידע בנוגע לאקולוגיה, פיזיולוגיה, התפתחות ואבולוציה של צמחים3. שיטות במורפולוגיה ואנטומיה של צמחים כוללות כיום פרוטוקולים, ציוד וידע שפותחו לאחרונה כמו גם לפני יותר ממאה שנה2. לביצוע והתאמה מתמשכים של שיטות קלאסיות (למשל, מיקרוסקופיית אור) יחד עם טכניקות עדכניות יותר (למשל, מיקרוסקופיה קונפוקלית, מיקרוטומוגרפיה של קרני רנטגן) יש אותו בסיס חיוני: ידע תיאורטי המאפשר פיתוח מתודולוגיה.
הכלי העיקרי באנטומיה ובמורפולוגיה של צמחים הוא התמונה. למרות התפיסה המוטעית שניתוחים כאלה הם תצפיות פשוטות, הנותנות מקום לפרשנויות סובייקטיביות2, ניתוח והבנה של תמונות בתחום זה דורש ידע בשיטות המיושמות (הציוד, סוג הניתוח, הליכים מתודולוגיים), מרכיבי התא, היסטוכימיה וגוף הצמח (ארגון ותפקוד רקמות, אונטוגניה, התאמות מורפולוגיות). פירוש התמונות המתקבלות במגוון שיטות יכול להוביל לקורלציה בין צורה ותפקוד, פענוח ההרכב הכימי של מבנה, אימות בתיאור טקסה, הבנת זיהומים על ידי פיטופתוגנים והערכות אחרות מסוג זה.
כאשר חוקרים צמחים מיקוהטרוטרופיים (MH) (כלומר, צמחים שאינם פוטוסינתטיים המקבלים פחמן מפטריות מיקוריזאליות4,5), היבטים יוצאי דופן של ההתאמות המבניות שלהם, דפוסי התיישבות הרקמות על ידי פטריות, והמורפואאנטומיה של איברים תת-קרקעיים יכולים להאיר את אסטרטגיות ההתפתחות שלהם ואת הקשרים שלהם עם hyphae, שהם המקור לחומרים מזינים. האיברים התת-קרקעיים של צמחי MH מראים בדרך כלל התאמות חשובות הקשורות לקשר שלהם עם פטריות אדמה, ולכן חיוני לבצע חקירות אנטומיות ומורפולוגיות אלה6. אין להתעלם מאיברים אוויריים של מיני MH, שכן אנדופיטים יכולים להימצא גם ברקמות אלה, גם אם הם אינם פטריות מיקוריזאליות (תצפיות אישיות, טרם פורסמו).
מלבד החיוניות המבוססת היטב של קשר פטריות מיקוריזאליות עם מיני MH במהלך כל מחזור החיים שלהם7, לכל מיני הסחלבים, אפילו האוטוטרופיים, יש שלב מיקוהטרוטרופי מחייב ראשוני בסביבות טבעיות. זה קורה כי העובר של הסחלבים הוא מובחן וחסר אנדוספרם או cotyledons, ובכך להיות מסוגל לפתח ולהתבסס בסביבות טבעיות ללא תמיכה תזונתיים של שותפים פטרייתיים 4,8. בהתחשב בכך, פרוטוקולי נביטה סימביוטיים יכולים להיות מיושמים לא רק על מיני MH אלא גם על פוטוסינתזה של סחלבים, במטרה לחקור את הספציפיות של פטריית הסחלבים בנביטה ובפיתוח פרוטוקורם, מתודולוגיה מיושמת במידה רבה ביוזמות לשימור מינים בסכנת הכחדה 9,10,11.
בהרכבת שיטות זו, אנו מתארים שלבים חשובים הכרוכים באיסוף, תיקון ואחסון דגימות צמחי MH למחקרים אנטומיים (סעיף 1), ניתוח פני שטח ובחירת דגימות (סעיף 2), שיטות חתך (יד חופשית: סעיף 3, מיקרוטומיה: סעיף 4, קריומיקרוטומיה: סעיף 5), צביעה והרכבה (סעיף 6), מיקרוסקופיה פלואורסצנטית וקונפוקלית של אנדופיטים פטרייתיים (סעיף 7), מיקרוסקופיית אלקטרונים סורקת (סעיף 8), ומיקרוסקופיית אלקטרונים (סעיף 9). בנוסף, אנו מתארים שיטת נביטה סימביוטית לזרעי סחלב (MH ואוטוטרופי, סעיף 10), שכן ניתן ליישם בהצלחה את שיטות ההדמיה שהוזכרו קודם לכן כדי לנתח התיישבות פטרייתית של זרעים, פרוטוקורמים ושתילים בתהליך הנביטה.
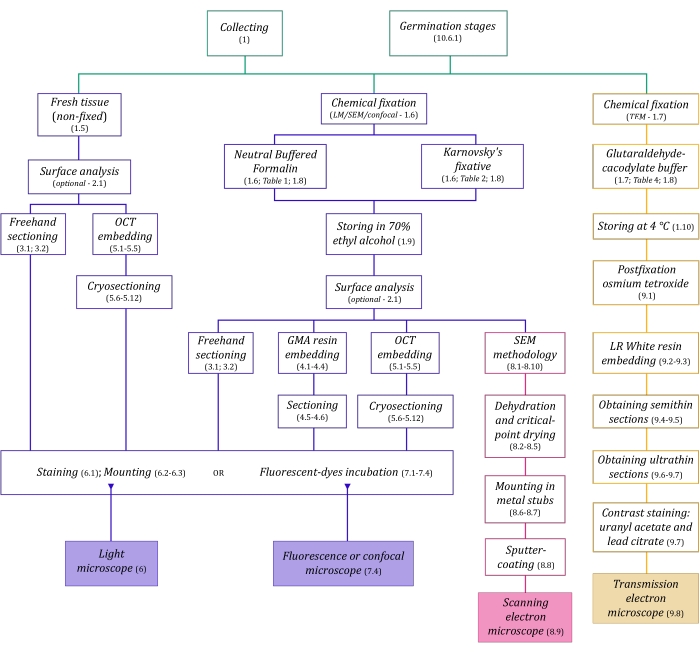
איור 1: סיכום סכמטי של שיטות הדמיה. הסכמות מספקות אינדיקציות לשלבי הפרוטוקול שבהם הן מפורטות. קיצורים: GMA = גליקול מתקרילט, OCT = תרכובת טמפרטורת חיתוך אופטימלית, SEM = מיקרוסקופ אלקטרונים סורק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לטכניקות המיקרוסקופיה המתוארות כאן בפירוט (איור 1) קדמו השלבים החיוניים הבאים: איסוף, תיקון, התייבשות, הטמעה וחיתוך דגימות. מכיוון שהשלבים משתנים (איור 1) בהתאם לטכניקות שנבחרו, חשוב לחשוב קדימה, בהתחשב בקיבועים שיש להכין ולהעביר לאתר האיסוף, כיצד יש להכין את הדגימות לפני התיקון, את תהליכי ההתייבשות שיש להשתמש בהם (סעיף 1), ואת אפשרויות ההטמעה ושיטות החיתוך השונות (סעיפים 4, 5, ו-9). איור 1 מסכם ברצף את כל השלבים הנדרשים עבור כל טכניקת מיקרוסקופיה המתוארת ביסודיות להלן.
Protocol
Representative Results
Discussion
לניתוחי תמונות באנטומיה ובמורפולוגיה של צמחים יש פוטנציאל חשוב להגשים מטרות ולסייע בהבנת הקשרים בין צמחים מיקוהטרוטרופיים לבין אנדופיטים פטרייתיים חיוניים שלהם, כפי שהוכח על ידי מחקרים של איברים תת-קרקעיים 6,40, ניתוחים מבניים של נביטה סימביוטית של זרעים39,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מודים למימון מ-FAEPEX ו-FAPESP (2015/26479-6). MPP מודה לקייפס על מלגת התואר השני שלו (תהליך 88887.600591/2021-00) ו- CNPq. JLSM מודה ל- CNPq על מענקי פרודוקטיביות (303664/2020-7). המחברים מודים גם על הגישה לציוד ולסיוע הניתנים על ידי LME (המעבדה למיקרוסקופיית אלקטרונים – IB/Unicamp), INFABiC (המכון הלאומי למדע וטכנולוגיה על פוטוניקה יישומית לביולוגיה של התא – Unicamp), ו- LaBiVasc (המעבדה לביולוגיה של כלי הדם – DBEF/IB/Unicamp); LAMEB (UFSC) ואליאנה דה מדיירוס אוליביירה (UFSC) על תרומות לפרוטוקול cryoprotection; LME עבור תרומות לפרוטוקול TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

