菌従属栄養植物組織における真菌のコロニー形成と種子の共生発芽を解釈するための顕微鏡技術
Summary
このプロトコルは、菌根菌で発芽した植物組織および種子における真菌コロニー形成を研究するために、走査型および透過型電子顕微鏡、光学顕微鏡、共焦点顕微鏡、蛍光顕微鏡などのさまざまな顕微鏡技術を適用して、マイコ従属栄養植物サンプルを収集、固定、および維持するための詳細な手順を提供することを目的としています。
Abstract
構造植物学は、植物の生態、生理、発達、進化を完全に理解するために不可欠な視点です。菌従属栄養植物(菌類から炭素を得る植物)を研究する場合、その構造適応、菌類による組織コロニー形成のパターン、地下器官の形態解剖学的構造などの顕著な側面は、その発生戦略と栄養源である菌糸との関係を解明することができます。共生菌のもう一つの重要な役割は、ランの種子の発芽に関連しています。すべてのラン科種は、発芽および実生段階(初期マイコヘテロトロフィー)の間に菌従属栄養性であり、成虫段階で光合成するものでさえあります。ランの種子には栄養貯蔵が不足しているため、真菌共生生物は基質を提供し、発芽を可能にするために不可欠です。構造的な観点から発芽段階を分析することは、真菌と種子との相互作用に関する重要な質問に答えることもできます。この記事で提案されているように、植物組織中の真菌内生植物を明らかにするために、さまざまなイメージング技術を適用できます。植物器官のフリーハンドおよび薄い切片を染色し、光学顕微鏡を使用して観察することができます。小麦胚芽凝集素に結合した蛍光色素を真菌に適用し、Calcofluor Whiteと共生して、共焦点顕微鏡で植物細胞壁を強調することができます。さらに、菌従属栄養ランの走査型および透過型電子顕微鏡の方法論が詳述されており、そのようなプロトコルを関連植物に適用する可能性が探求されています。ラン種子の共生発芽(すなわち、菌根菌の存在下で)は、光、共焦点、および電子顕微鏡による分析のために発芽の異なる段階から得られた構造を調製する可能性とともに、プロトコルに詳細に記載されている。
Introduction
植物の形態学と解剖学を網羅する植物学の構造研究は、生物全体を理解する上で基礎であり1,2、植物の生態・生理・発生・進化に関する知識を統合し、貢献するために不可欠な視点を提供します3。植物の形態学と解剖学の方法は、現在、最近および1世紀以上前に開発されたプロトコル、機器、および知識で構成されています2。古典的な方法(光学顕微鏡など)の継続的な実行と適応は、より最近の技術(共焦点顕微鏡、X線マイクロトモグラフィーなど)と同じ本質的な基礎を持っています:方法論の開発を可能にする理論的知識。
植物の解剖学と形態学の主なツールは画像です。このような分析は単純な観察であるという誤解にもかかわらず、主観的な解釈にスペースを与えます2、この領域の画像を分析および理解するには、適用される方法(機器、分析の種類、方法論的手順)、細胞成分、組織化学、および植物体(組織の組織と機能、個体発生、形態学的適応)。さまざまな 方法で得られた画像を 解釈することで、形態と機能の相関、構造の化学組成の解読、分類群の記述の裏付け、植物病原体による感染の理解などにつながります。
菌従属栄養植物(菌根菌から炭素を得る非光合成植物4,5)を研究する場合、その構造適応、真菌による組織コロニー形成のパターン、および地下器官の形態解剖学的構造の顕著な側面は、それらの発生戦略と栄養素の源である菌糸との関係を啓発することができます。MH植物の地下器官は通常、土壌真菌との関連に関連する重要な適応を示すため、これらの解剖学的および形態学的調査を行うことが不可欠です6。MH種の空中器官は、菌根菌でなくても、これらの組織にも内生菌が存在する可能性があるため、無視してはなりません(個人的な観察、まだ公開されていません)。
菌根菌とMH種との関連がライフサイクル全体にわたって確立された必須性に加えて7、すべてのラン種は、独立栄養種でさえ、自然環境において最初の絶対的な菌従属栄養段階を持っています。これは、ランの胚が未分化であり、胚乳や子葉を欠いているため、真菌パートナーの栄養サポートなしに自然環境で発達および確立することができないために発生します4,8。それを考慮すると、共生発芽プロトコルはMH種だけでなく、光合成ランにも適用でき、発芽と原始球の発生におけるラン菌特異性を調査することを目的としており、絶滅危惧種の保全イニシアチブに広く適用されている方法論です9,10,11。
この方法の組み立てでは、解剖学的研究のためのMH植物サンプルの収集、固定、および保管(セクション1)、表面分析とサンプル選択(セクション2)、セクショニング方法(フリーハンド:セクション3、ミクロトミー:セクション4、クライオミクロトミー:セクション5)、染色とマウント(セクション6)、真菌内生植物の蛍光および共焦点顕微鏡(セクション7)、走査型電子顕微鏡(セクション8)、 透過型電子顕微鏡(セクション9)。さらに、ラン種子の共生発芽法(MHと独立栄養、セクション10)について述べ、前述のイメージング法は、発芽過程における種子、原球菌、および苗の真菌コロニー形成の分析にうまく適用できるためです。
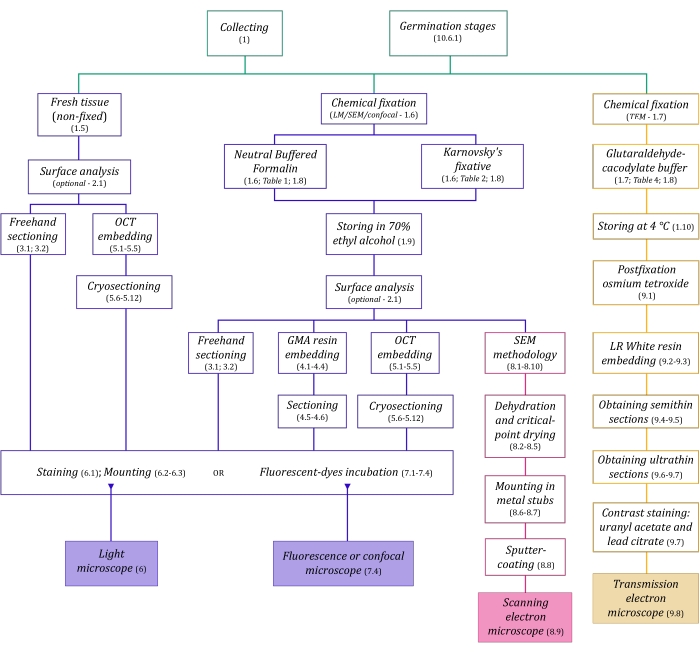
図1:イメージング方法の概略図。回路図は、それらが詳述されているプロトコルステップの指示を提供します。略語:GMA =グリコールメタクリレート、OCT =最適な切断温度化合物、SEM =走査型電子顕微鏡。この図の拡大版を表示するには、ここをクリックしてください。
ここで詳細に説明する顕微鏡技術(図1)の前には、サンプルの収集、固定、脱水、埋め込み、および切片作成という重要なステップがあります。手順は選択した技術に応じて可変であるため(図1)、準備して収集サイトに輸送する固定液、固定前のサンプルの準備方法、使用する脱水プロセス(セクション1)、およびさまざまな埋め込みの可能性とセクショニング方法(セクション4、5、 および9)。 図1 は、以下に徹底的に説明する各顕微鏡技術に必要なすべてのステップを順番にまとめたものです。
Protocol
Representative Results
Discussion
植物の解剖学と形態学における画像解析は、地下器官の研究6,40、種子の共生発芽の構造解析39、および空中および生殖構造41によって実証されるように、目的を達成し、マイコ従属栄養植物とその不可欠な真菌内生植物の関係を理解するのに役立つ重要な可能性を秘めています。.構造植物学は、過去10年間で植物…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、FAEPEXおよびFAPESP(2015/26479-6)からの資金提供に感謝する。MPPは、修士号奨学金(プロセス88887.600591 / 2021-00)とCNPqに感謝します。 JLSMは、生産性助成金(303664 / 2020-7)に対してCNPqに感謝します。著者らはまた、LME(電子顕微鏡研究所-IB /ユニキャンプ)、INFABiC(細胞生物学に適用されるフォトニクスに関する国立科学技術研究所-ユニキャンプ)、およびLaBiVasc(血管生物学研究所-DBEF / IB /ユニキャンプ)によって提供される機器と支援へのアクセスに感謝します。LAMEB(UFSC)およびエリアナ・デ・メデイロス・オリベイラ(UFSC)は、凍結保護プロトコルへの貢献に対して。TEMプロトコルへの貢献のためのLME。
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

