Методы микроскопии для интерпретации грибковой колонизации в микогетеротрофных тканях растений и симбиотической прорастания семян
Summary
Этот протокол направлен на обеспечение подробных процедур сбора, фиксации и поддержания микогетеротрофных образцов растений, применяя различные методы микроскопии, такие как сканирующая и просвечивающая электронная микроскопия, световая, конфокальная и флуоресцентная микроскопия для изучения грибковой колонизации в тканях растений и семенах, прорастающих микоризными грибами.
Abstract
Структурная ботаника является незаменимой перспективой для полного понимания экологии, физиологии, развития и эволюции растений. При исследовании микогетеротрофных растений (то есть растений, которые получают углерод из грибов) замечательные аспекты их структурных адаптаций, закономерности колонизации тканей грибами и морфоанатомия подземных органов могут просветить их стратегии развития и их отношения с гифами, источником питательных веществ. Еще одна важная роль симбиотических грибов связана с прорастанием семян орхидеи; все виды Orchidaceae являются микогетеротрофными на стадии прорастания и рассады (начальная микогетеротрофия), даже те, которые фотосинтезируют на взрослых стадиях. Из-за отсутствия питательных запасов в семенах орхидей грибковые симбионты необходимы для обеспечения субстратов и обеспечения прорастания. Анализ стадий прорастания по структурным перспективам также может ответить на важные вопросы, касающиеся взаимодействия грибов с семенами. Различные методы визуализации могут быть применены для выявления эндофитов грибов в тканях растений, как предлагается в этой статье. От руки и тонкие участки органов растений можно окрашивать, а затем наблюдать с помощью световой микроскопии. Фторхром, конъюгированный с агглютинином зародышей пшеницы, может быть применен к грибам и инкубирован совместно с Calcofluor White для выделения клеточных стенок растений в конфокальной микроскопии. Кроме того, подробно описаны методологии сканирующей и просвечивающей электронной микроскопии для микогетеротрофных орхидей, а также исследуются возможности применения таких протоколов в родственных растениях. Симбиотическое прорастание семян орхидеи (т.е. в присутствии микоризных грибов) подробно описано в протоколе, наряду с возможностями подготовки структур, полученных с разных стадий прорастания, для анализов с помощью световой, конфокальной и электронной микроскопии.
Introduction
Структурные исследования в ботанике, охватывающие морфологию и анатомию растений, являются базовыми для понимания всего организма 1,2 и обеспечивают необходимые перспективы для интеграции и внесения вклада в знания об экологии, физиологии, развитии и эволюции растений3. Методы в морфологии и анатомии растений в настоящее время включают протоколы, оборудование и знания, разработанные недавно, а также более века назад2. Непрерывное выполнение и адаптация классических методов (например, световая микроскопия) наряду с более современными методами (например, конфокальной микроскопией, рентгеновской микротомографией) имеют одну и ту же существенную основу: теоретические знания, позволяющие разрабатывать методологию.
Основным инструментом в анатомии и морфологии растений является изображение. Несмотря на ошибочное представление о том, что такие анализы являются простыми наблюдениями, давая пространство субъективным интерпретациям2, анализ и понимание изображений в этой области требует знания применяемых методов (оборудование, тип анализа, методологические процедуры), клеточных компонентов, гистохимии и растительного тела (организация и функция тканей, онтогенез, морфологические адаптации). Интерпретация изображений, полученных с помощью различных методов, может привести к корреляции формы и функции, расшифровке химического состава структуры, подтверждению в описании таксонов, пониманию инфекций фитопатогенами и другим подобным оценкам.
При исследовании микогетеротрофных (MH) растений (т.е. нефотосинтезирующих растений, получающих углерод из микоризных грибов 4,5) замечательные аспекты их структурных адаптаций, закономерности колонизации тканей грибами и морфоанатомия подземных органов могут просветить их стратегии развития и отношения с гифами, которые являются источником питательных веществ. Подземные органы растений MH обычно демонстрируют важные адаптации, связанные с их связью с почвенными грибами, поэтому необходимо выполнить эти анатомические и морфологические исследования6. Не следует игнорировать воздушные органы видов MH, так как эндофиты также могут присутствовать в этих тканях, даже если они не являются микоризными грибами (личные наблюдения, пока не опубликованы).
Помимо устоявшейся сущности ассоциации микоризных грибов с видами MH в течение всего их жизненного цикла7, каждый вид орхидеи, даже автотрофный, имеет начальную облигатную микогетеротрофную стадию в естественной среде. Это происходит потому, что эмбрион орхидеи недифференцирован и не имеет эндосперма или семядолий, таким образом, будучи неспособным развиваться и утвердиться в естественной среде без питательной поддержки грибковых партнеров 4,8. Учитывая, что протоколы симбиотического прорастания могут применяться не только к видам MH, но и к фотосинтезирующим орхидеям, с целью изучения специфичности орхидеи-гриба в прорастании и развитии протокормы, широко применяемая методология в инициативах по сохранению угрожаемых видов 9,10,11.
В этой сборке методов мы описываем важные этапы, связанные со сбором, фиксацией и хранением образцов растений MH для анатомических исследований (раздел 1), анализа поверхности и отбора образцов (раздел 2), методов секционирования (от руки: раздел 3, микротомия: секция 4, криомикротомия: секция 5), окрашивание и монтаж (раздел 6), флуоресценция и конфокальная микроскопия грибковых эндофитов (раздел 7), сканирующая электронная микроскопия (секция 8), и просвечивающая электронная микроскопия (раздел 9). Кроме того, мы описываем симбиотический метод прорастания семян орхидей (MH и автотрофный, раздел 10), поскольку ранее упомянутые методы визуализации могут быть успешно применены для анализа грибковой колонизации семян, протокорм и саженцев в процессе прорастания.
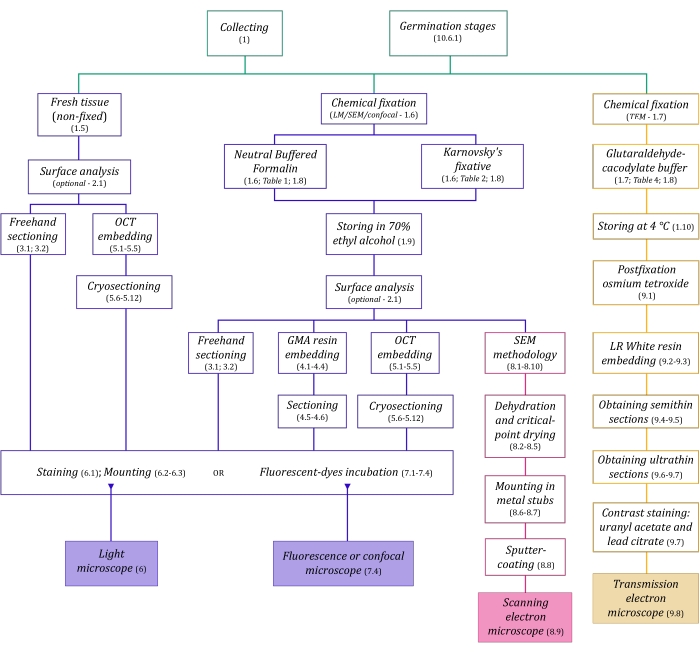
Рисунок 1: Схематическое обобщение методов визуализации. Схемы содержат указания на этапы протокола, в которых они подробно описаны. Сокращения: GMA = метакрилат гликоля, OCT = соединение оптимальной температуры резания, SEM = сканирующая электронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Методам микроскопии, подробно описанным здесь (рисунок 1), предшествуют следующие основные этапы: сбор, фиксация, обезвоживание, встраивание и секционирование образцов. Поскольку этапы являются переменными (рисунок 1) в зависимости от выбранного метода (методов), важно думать заранее, учитывая фиксаторы, которые должны быть подготовлены и транспортированы на место сбора, как образцы должны быть подготовлены перед фиксацией, процессы обезвоживания, которые будут использоваться (раздел 1), а также различные возможности встраивания и методы секционирования (разделы 4, 5, и 9). На рисунке 1 последовательно обобщены все этапы, необходимые для каждого метода микроскопии, подробно описанного ниже.
Protocol
Representative Results
Discussion
Анализ изображений в анатомии и морфологии растений имеет важный потенциал для достижения целей и помогает понять взаимосвязи между микогетеротрофными растениями и их незаменимыми грибковыми эндофитами, о чем свидетельствуют исследования подземных органов 6,40<sup cl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят финансирование от FAEPEX и FAPESP (2015/26479-6). MPP благодарит Кейпса за стипендию магистратуры (процесс 88887.600591/2021-00), а CNPq. JLSM благодарит CNPq за гранты на производительность (303664/2020-7). Авторы также благодарят доступ к оборудованию и помощь, предоставляемые LME (Лаборатория электронной микроскопии – IB / Unicamp), INFABiC (Национальный институт науки и техники по фотонике, применяемой к клеточной биологии – Unicamp) и LaBiVasc (Лаборатория сосудистой биологии – DBEF / IB / Unicamp); LAMEB (UFSC) и Eliana de Medeiros Oliveira (UFSC) за вклад в протокол криозащиты; LME за вклад в протокол ТЕА.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

