用于视觉假体研究的视网膜神经元计算建模 - 基本方法
Summary
我们总结了一个工作流程,以计算方式模拟视网膜神经元对电刺激的反应。该计算模型是通用的,包括自动化步骤,可用于模拟一系列生理场景和预测未来 体内/体外 研究的结果。
Abstract
计算建模由于其预测 体内 和 体外 系统行为的能力,已成为神经工程中越来越重要的方法。这具有关键优势,即通过提供通常非常精确的生理结果预测来最大限度地减少给定研究中所需的动物数量。在视觉假体领域,计算建模具有一系列实际应用,包括为植入式电极阵列的设计提供信息,以及预测可能通过从所述阵列传递电脉冲而引发的视觉感知。文献中描述的一些模型结合了三维(3D)形态来计算电场和感兴趣的神经元或神经网络的电缆模型。为了增加这种两步法对那些在计算建模方面经验有限的研究人员的可访问性,我们提供了一个视频,介绍了要采取的基本方法,以便构建计算模型并利用它来预测 通过部署 的刺激方案的生理和心理物理结果。 视觉假体。该指南包括在有限元建模(FEM)软件中构建3D模型的步骤,在多区室神经元计算软件中构建视网膜神经节细胞模型的步骤,然后将两者合并。用于数值求解物理方程的有限元建模软件将用于求解组织电刺激中的电场分布。然后,使用专门的软件来模拟神经细胞或网络的电活动。要遵循本教程,需要熟悉神经假体的工作原理以及神经生理学概念(例如,动作电位机制和对霍奇金-赫胥黎模型的理解)。
Introduction
视觉神经假体是一组向视觉通路中的神经细胞提供刺激(电、光等)以产生光幻觉或看到光的感觉的装置。这是一种治疗策略,对于由退行性视网膜疾病引起的永久性失明的人,已经在临床上使用近十年。通常,一个完整的系统将包括一个捕获用户周围视觉信息的外部摄像头,一个电源和计算单元,用于处理图像并将其转换为一系列电脉冲,以及一个植入的电极阵列,该电极阵列连接神经组织并将电脉冲传递到神经细胞。工作原理允许视觉神经假体放置在从视网膜到视觉皮层的视觉通路的不同位置,只要它位于受损组织的下游。目前视觉神经假体的大多数研究都集中在提高刺激的功效和提高空间敏锐度以提供更自然的视觉上。
在提高刺激功效的努力中,计算建模一直是验证假体设计和模拟其视觉结果的一种经济和时间有效的方法。自1999年以来,该领域的计算建模越来越受欢迎,因为Greenberg1模拟了视网膜神经节细胞对细胞外电刺激的反应。从那时起,计算建模一直用于优化电脉冲2,3的参数或电极4,5的几何设计。尽管复杂性和研究问题各不相同,但这些模型通过确定介质(例如神经组织)中的电压分布并估计附近神经元因电压而产生的电响应来工作。
导体中的电压分布可以通过求解所有位置的泊松方程6 来找到:
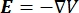
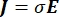
其中 E 是电场, V 是电势, J 是电流密度,σ 是电导率。公式中的 表示 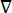 梯度运算符。在静止电流的情况下,对模型施加以下边界条件:
梯度运算符。在静止电流的情况下,对模型施加以下边界条件:
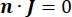
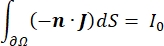
其中 n 是表面的法线,Ω 表示边界, I0 表示比电流。它们一起在外部边界产生电绝缘,并为选定的边界创建电流源。如果我们假设单极点源位于具有各向同性电导率的均质介质中,则任意位置的细胞外电势可以由7计算:
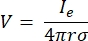
其中 Ie是电流,是电极和测量点之间的距离。当介质不均匀或各向异性,或者电极阵列有多个电极时,使用计算套件来数值求解方程会很方便。有限元建模软件6 将体积导体分解为称为“单元”的小部分。这些元素相互连接,使得一个元素的变化影响其他元素的变化,它求解了用于描述这些元素的物理方程。随着现代计算机计算速度的提高,这个过程可以在几秒钟内完成。一旦计算出电势,就可以估计神经元的电响应。
神经元以电信号的形式发送和接收信息。这种信号有两种形式 – 分级电位和动作电位。分级电位是膜电位的临时变化,其中膜上的电压变得更加正(去极化)或负(超极化)。分级电位通常具有局部效应。在产生它们的细胞中,动作电位是可以沿着轴突长度长距离传播的全有或全无反应。梯度电位和动作电位对电气和化学环境都很敏感。当跨膜电位阈值越过时,各种神经元细胞类型(包括视网膜神经节细胞)可以产生动作电位尖峰。动作电位尖峰和传播然后触发信号到下游神经元的突触传递。神经元可以建模为分为圆柱形段的电缆,其中每个段由于脂质双层膜8而具有电容和电阻。神经元计算程序9 可以通过将细胞离散为多个区室并求解数学模型10 来估计可电兴奋细胞的电活动:
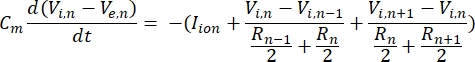
在该方程中,Cm是膜电容,V e,n是节点n处的细胞外电位,Vi,n是节点n处的细胞内电位,R n是节点n处的细胞内(纵向)电阻,I离子是通过节点 n处离子通道的离子电流。当刺激处于活动状态时,FEM 模型中的 V 值对于神经元中的所有节点实现为 Ve,n。
来自离子通道的跨膜电流可以使用霍奇金-赫胥黎公式11进行建模:
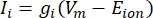
其中g i是通道的比电导,V m是跨膜电位(V i,n – Ve,n),E离子是离子通道的反转电位。对于电压门控通道,例如Na通道,引入了描述通道打开或关闭概率的无量纲参数m和h:
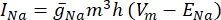
其中 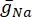 是特定离子通道的最大膜电导率,参数 m 和 h 的值由微分方程定义:
是特定离子通道的最大膜电导率,参数 m 和 h 的值由微分方程定义:
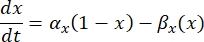
其中 αx 和βx 是定义离子通道速率常数的电压相关函数。它们通常采用以下形式:
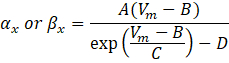
这些方程中的参数值,包括最大电导率,以及常数A、B、C和D,通常从经验测量中找到。
使用这些构建基块,可以按照所述步骤构建不同复杂性的模型。当泊松方程无法解析求解时,例如体积导体中的不均匀或各向异性电导或电极阵列的几何形状复杂时,FEM 软件非常有用。求解细胞外电位值后,可以在神经元计算软件中对神经元电缆模型进行数值求解。结合这两个软件,可以将复杂的神经元单元或网络计算成非均匀电场。
将使用上述程序构建脉络膜上刺激下的视网膜神经节细胞的简单两步模型。在这项研究中,视网膜神经节细胞将受到一系列幅度的电流脉冲。细胞相对于刺激的位置也不同,以显示距离-阈值关系。此外,该研究还包括使用不同尺寸的刺激电极12对皮质活化阈值的体内研究对计算结果的验证,以及显示电极 – 神经元距离与激活阈值13之间关系的体外研究。
Protocol
Representative Results
Discussion
在本文中,我们展示了一种结合了有限元和生物物理神经元建模的建模工作流程。该模型非常灵活,因为它的复杂性可以修改以适应不同的目的,并且它提供了一种根据经验发现验证结果的方法。我们还演示了如何参数化模型以实现自动化。
两步建模方法结合了使用FEM和神经元计算套件的优势,在细胞外刺激存在的情况下求解神经元的电缆方程。FEM 可用于精确计算体积导体?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项研究由国家卫生和医学研究委员会项目资助(资助号1109056)。
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neuroscience. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

