시각 보철물 연구를 위한 망막 뉴런의 전산 모델링 - 기본 접근
Summary
우리는 전기 자극에 대한 반응으로 망막 뉴런의 행동을 계산적으로 모델링하는 워크 플로를 요약합니다. 계산 모델은 다목적이며 다양한 생리적 시나리오를 시뮬레이션하고 향후 생체 내/체외 연구의 결과를 예측하는 데 유용한 자동화 단계를 포함합니다.
Abstract
컴퓨터 모델링은 생체 내 및 체외 시스템의 동작을 예측할 수있는 능력으로 인해 신경 공학에서 점점 더 중요한 방법이되었습니다. 이것은 종종 생리적 결과에 대한 매우 정확한 예측을 제공함으로써 주어진 연구에 필요한 동물의 수를 최소화하는 주요 이점이 있습니다. 시각 보철물 분야에서, 컴퓨터 모델링은 이식형 전극 어레이의 설계를 알리고, 상기 어레이로부터의 전기 충격의 전달을 통해 유도될 수 있는 시각적 지각의 예측을 포함하는 일련의 실용적인 응용을 갖는다. 문헌에 기술된 일부 모델은 3차원(3D) 형태를 결합하여 전기장을 계산하고 관심 있는 뉴런 또는 신경망의 케이블 모델을 결합합니다. 전산 모델링에 대한 사전 경험이 제한적일 수 있는 연구자에게 이 2단계 방법의 접근성을 높이기 위해 우리는 전산 모델을 구성하고 다음을 통해 배포된 자극 프로토콜의 생리학적 및 정신물리학적 결과를 예측하는 데 활용하기 위해 취해야 할 기본 접근 방식에 대한 비디오를 제공합니다. 시각적 보철물. 이 가이드는 FEM(유한 요소 모델링) 소프트웨어에서 3D 모델을 구축하는 단계, 다중 구획 뉴런 계산 소프트웨어에서 망막 신경절 세포 모델 구성, 이 둘의 융합으로 구성됩니다. 물리 방정식을 수치 적으로 풀기위한 유한 요소 모델링 소프트웨어는 조직의 전기 자극에서 전기장 분포를 해결하는 데 사용됩니다. 그런 다음 신경 세포 또는 네트워크의 전기적 활동을 시뮬레이션하는 특수 소프트웨어가 사용되었습니다. 이 튜토리얼을 따르려면 신경 보철물의 작동 원리와 신경 생리 학적 개념 (예 : 활동 전위 메커니즘 및 Hodgkin-Huxley 모델에 대한 이해)에 익숙해야합니다.
Introduction
시각 신경 보철물은 시각 경로의 신경 세포에 자극 (전기, 빛 등)을 전달하여 포스펜 또는 빛을 보는 감각을 만드는 장치 그룹입니다. 퇴행성 망막 질환으로 인한 영구 실명 환자를 위해 거의 10 년 동안 임상 적으로 사용 된 치료 전략입니다. 일반적으로 전체 시스템에는 사용자 주변의 시각 정보를 캡처하는 외부 카메라, 이미지를 처리하고 일련의 전기 펄스로 변환하는 전원 공급 장치 및 컴퓨팅 장치, 신경 조직을 인터페이스하고 전기 펄스를 신경 세포에 전달하는 이식된 전극 어레이가 포함됩니다. 작동 원리는 시각 신경 보철물이 손상된 조직의 하류에있는 한 망막에서 시각 피질까지의 시각 경로를 따라 다른 부위에 배치 될 수있게합니다. 시각 신경 보철물에 대한 현재 연구의 대부분은 자극의 효능을 높이고 공간 시력을 개선하여보다 자연스러운 시력을 제공하는 데 중점을 둡니다.
자극의 효능을 개선하기 위한 노력에서 컴퓨터 모델링은 보철물 디자인을 검증하고 시각적 결과를 시뮬레이션하는 비용 및 시간 효율적인 방법이었습니다. 이 분야의 컴퓨터 모델링은 Greenberg1이 세포 외 전기 자극에 대한 망막 신경절 세포의 반응을 모델링함에 따라 1999 년부터 인기를 얻었습니다. 그 이후로, 전산 모델링은 전기 펄스 (2,3)의 파라미터 또는 전극(4,5)의 기하학적 설계를 최적화하기 위해 사용되었다. 복잡성과 연구 질문의 변화에도 불구하고 이러한 모델은 매체 (예 : 신경 조직)의 전기 전압 분포를 결정하고 주변의 뉴런이 전압으로 인해 생성 할 전기 반응을 추정함으로써 작동합니다.
도체의 전압 분포는 모든 위치에서 푸아송 방정식6 을 풀어 찾을 수 있습니다.
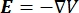
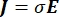
여기서 E 는 전기장, V 는 전위, J 는 전류 밀도, σ 는 전기 전도도입니다. 방정식에서 는  기울기 연산자를 나타냅니다. 고정 전류의 경우 모델에 다음 경계 조건이 적용됩니다.
기울기 연산자를 나타냅니다. 고정 전류의 경우 모델에 다음 경계 조건이 적용됩니다.
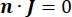
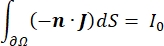
여기서 n은 표면에 수직, Ω는 경계를 나타내고, I0는 특정 전류를 나타낸다. 함께 외부 경계에서 전기 절연을 생성하고 선택한 경계에 대한 전류 소스를 생성합니다. 등방성 전도도를 갖는 균질 한 매질에서 단극 점 소스를 가정하면 임의의 위치에서의 세포 외 전위는7로 계산할 수 있습니다.
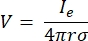
여기서 Ie 는 전류이고 전극과 측정 지점 사이의 거리입니다. 매체가 불균일하거나 이방성이거나 전극 어레이에 여러 전극이있는 경우 방정식을 수치 적으로 풀기위한 계산 제품군이 편리 할 수 있습니다. 유한 요소 모델링 소프트웨어(6 )는 체적 도체를 ‘요소’로 알려진 작은 섹션으로 나눕니다. 요소는 서로 상호 연결되어 한 요소의 변화 효과가 다른 요소의 변화에 영향을 미치고 이러한 요소를 설명하는 데 사용되는 물리적 방정식을 해결합니다. 최신 컴퓨터의 계산 속도가 증가함에 따라이 프로세스는 몇 초 내에 완료 될 수 있습니다. 전위가 계산되면 뉴런의 전기적 반응을 추정 할 수 있습니다.
뉴런은 전기 신호의 형태로 정보를 송수신합니다. 이러한 신호는 등급이 매겨진 전위와 활동 전위의 두 가지 형태로 제공됩니다. 등급이 매겨진 전위는 멤브레인 전위에 대한 일시적인 변화로, 멤브레인 양단의 전압이 더 양수(탈분극) 또는 음(과분극)이 됩니다. 등급이 매겨진 전위에는 일반적으로 국부적인 효과가 있습니다. 그것들을 생산하는 세포에서 활동 전위는 축삭의 길이를 따라 먼 거리를 이동할 수있는 전부 또는 전무 반응입니다. 등급 전위와 활동 전위 모두 전기적 및 화학적 환경에 민감합니다. 활동 전위 스파이크는 막횡단 전위가 교차 될 때 망막 신경절 세포를 포함한 다양한 신경 세포 유형에 의해 생성 될 수 있습니다. 활동 전위 스파이크 및 전파는 다운 스트림 뉴런으로의 신호의 시냅스 전달을 유발합니다. 뉴런은 원통형 세그먼트로 분할되는 케이블로서 모델링될 수 있으며, 여기서 각 세그먼트는 지질 이중층막(8)으로 인해 커패시턴스 및 저항을 갖는다. 뉴런 전산 프로그램(9)은 세포를 다수의 구획으로 이산화하고 수학적 모델(10)을 해결함으로써 전기적으로 흥분성 세포의 전기적 활동을 추정할 수 있다: Neuron computational programme9 can estimate the 전기적 activity of the electrical activity of the electrical activity of the communication-revitable cell into the multiple compartments into the schemating and the mathematical model(10):
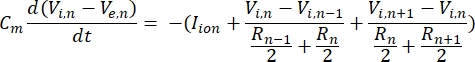
이 방정식에서, Cm은 막 커패시턴스, Ve, n은 노드 n에서의 세포외 전위, Vi,n은 노드 n에서의 세포내 전위, Rn은 노드 n에서의 세포내(종단) 저항, 및 I이온은 노드 n에서의 이온 채널을 통과하는 이온 전류이다. FEM 모델의 V 값은 자극이 활성화될 때 뉴런의 모든 노드에 대해 Ve,n으로 구현됩니다.
이온 채널로부터의 막횡단 전류는 Hodgkin-Huxley 제형11을 사용하여 모델링할 수 있다:
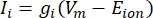
여기서 gi는 채널의 특정 컨덕턴스, Vm은 막횡단 전위(Vi,n – Ve,n) 및 E 이온은 이온 채널의 반전 전위이다. Na 채널과 같은 전압 게이트 채널의 경우 채널을 열거나 닫을 확률을 설명하는 무차원 매개변수 m 및 h가 도입됩니다.
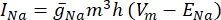
여기서 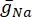 는 특정 이온 채널에 대한 최대 막 전도도이며, 파라미터 m 및 h 의 값은 미분 방정식에 의해 정의된다.
는 특정 이온 채널에 대한 최대 막 전도도이며, 파라미터 m 및 h 의 값은 미분 방정식에 의해 정의된다.
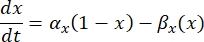
여기서 α x 및 βx는 이온 채널의 속도 상수를 정의하는 전압 종속 함수입니다. 일반적으로 다음과 같은 형식을 취합니다.
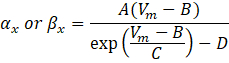
최대 컨덕턴스와 상수 A, B, C, D를 포함한 이러한 방정식의 파라미터 값은 일반적으로 경험적 측정에서 발견되었습니다.
이러한 빌딩 블록을 사용하면 설명된 단계에 따라 다양한 복잡성의 모델을 구축할 수 있습니다. FEM 소프트웨어는 부피 컨덕터의 비균질 또는 이방성 전도도 또는 전극 어레이의 형상이 복잡한 경우와 같이 포아송 방정식을 해석적으로 풀 수 없는 경우에 유용합니다. 세포외 전위 값이 해결된 후, 뉴런 케이블 모델은 뉴런 계산 소프트웨어에서 수치적으로 풀릴 수 있습니다. 두 소프트웨어를 결합하면 복잡한 뉴런 세포 또는 네트워크를 불균일 한 전기장으로 계산할 수 있습니다.
suprachoroidal 자극을받는 망막 신경절 세포의 간단한 2 단계 모델은 앞서 언급 한 프로그램을 사용하여 구축 될 것입니다. 이 연구에서 망막 신경절 세포는 다양한 크기의 전류 펄스를 받게됩니다. 자극에 대한 세포의 위치는 또한 거리-역치 관계를 보여주기 위해 변화된다. 더욱이, 본 연구는 상이한 크기의 자극 전극(12)을 이용한 피질 활성화 역치의 생체내 연구에 대한 계산 결과의 검증뿐만 아니라, 전극-뉴런 거리와 활성화 역치(13) 사이의 관계를 보여주는 시험관내 연구를 포함한다.
Protocol
Representative Results
Discussion
이 논문에서는 유한 요소와 생물 물리학 적 뉴런 모델링을 결합한 모델링 워크 플로우를 시연했습니다. 이 모델은 다양한 목적에 맞게 복잡성을 수정할 수 있으므로 매우 유연하며 경험적 결과에 대해 결과를 검증하는 방법을 제공합니다. 또한 자동화를 가능하게 하기 위해 모델을 매개 변수화하는 방법도 시연했습니다.
2단계 모델링 방법은 FEM과 뉴런 계산 제품군을 사용하?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 국립 보건 및 의학 연구위원회 프로젝트 보조금 (보조금 번호 1109056)의 지원을 받습니다.
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neuroscience. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

