Modélisation computationnelle des neurones rétiniens pour la recherche sur les prothèses visuelles - Approches fondamentales
Summary
Nous résumons un flux de travail pour modéliser informatiquement les comportements d’un neurone rétinien en réponse à une stimulation électrique. Le modèle informatique est polyvalent et comprend des étapes d’automatisation utiles pour simuler une gamme de scénarios physiologiques et anticiper les résultats des futures études in vivo / in vitro .
Abstract
La modélisation informatique est devenue une méthode de plus en plus importante en ingénierie neuronale en raison de sa capacité à prédire les comportements des systèmes in vivo et in vitro . Cela a le principal avantage de minimiser le nombre d’animaux requis dans une étude donnée en fournissant une prédiction souvent très précise des résultats physiologiques. Dans le domaine de la prothèse visuelle, la modélisation informatique a un éventail d’applications pratiques, y compris l’information sur la conception d’un réseau d’électrodes implantables et la prédiction des percepts visuels qui peuvent être obtenus par la délivrance d’impulsions électriques dudit réseau. Certains modèles décrits dans la littérature combinent une morphologie tridimensionnelle (3D) pour calculer le champ électrique et un modèle de câble du neurone ou du réseau neuronal d’intérêt. Afin d’accroître l’accessibilité de cette méthode en deux étapes pour les chercheurs qui peuvent avoir une expérience préalable limitée en modélisation informatique, nous fournissons une vidéo des approches fondamentales à adopter afin de construire un modèle informatique et de l’utiliser pour prédire les résultats physiologiques et psychophysiques des protocoles de stimulation déployés via une prothèse visuelle. Le guide comprend les étapes de construction d’un modèle 3D dans un logiciel de modélisation par éléments finis (FEM), la construction d’un modèle de cellules ganglionnaires de la rétine dans un logiciel de calcul de neurones multicompartimentaux, suivie de la fusion des deux. Un logiciel de modélisation par éléments finis pour résoudre numériquement des équations physiques serait utilisé pour résoudre la distribution du champ électrique dans les stimulations électriques des tissus. Ensuite, un logiciel spécialisé pour simuler les activités électriques d’une cellule ou d’un réseau neuronal a été utilisé. Pour suivre ce tutoriel, une connaissance du principe de fonctionnement d’une neuroprothèse, ainsi que des concepts neurophysiologiques (par exemple, le mécanisme du potentiel d’action et une compréhension du modèle de Hodgkin-Huxley), serait nécessaire.
Introduction
Les neuroprothèses visuelles sont un groupe de dispositifs qui délivrent des stimulations (électriques, lumineuses, etc.) aux cellules neurales dans la voie visuelle pour créer des phosphènes ou la sensation de voir la lumière. Il s’agit d’une stratégie de traitement qui est utilisée en clinique depuis près d’une décennie pour les personnes atteintes de cécité permanente causée par des maladies dégénératives de la rétine. En règle générale, un système complet comprend une caméra externe qui capture les informations visuelles autour de l’utilisateur, une unité d’alimentation et de calcul pour traiter et traduire l’image en une série d’impulsions électriques, et un réseau d’électrodes implantées qui interface le tissu neural et délivre les impulsions électriques aux cellules neurales. Le principe de fonctionnement permet de placer une neuroprothèse visuelle à différents endroits le long de la voie visuelle allant de la rétine au cortex visuel, à condition qu’elle soit en aval du tissu endommagé. La majorité des recherches actuelles en neuroprothèses visuelles se concentrent sur l’augmentation de l’efficacité de la stimulation et l’amélioration de l’acuité spatiale pour fournir une vision plus naturelle.
Dans les efforts visant à améliorer l’efficacité de la stimulation, la modélisation informatique a été une méthode rentable et rapide pour valider la conception d’une prothèse et simuler son résultat visuel. La modélisation informatique dans ce domaine a gagné en popularité depuis 1999 lorsque Greenberg1 a modélisé la réponse d’une cellule ganglionnaire rétinienne à des stimuli électriques extracellulaires. Depuis lors, la modélisation informatique a été utilisée pour optimiser les paramètres de l’impulsion électrique2,3 ou la conception géométrique de l’électrode 4,5. Malgré la variation de la complexité et des questions de recherche, ces modèles fonctionnent en déterminant la distribution de tension électrique dans le milieu (par exemple, le tissu neural) et en estimant la réponse électrique que les neurones à proximité produiront en raison de la tension électrique.
La distribution de tension électrique dans un conducteur peut être trouvée en résolvant les équations de Poisson6 à tous les endroits:
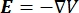
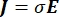
où E est le champ électrique, V le potentiel électrique, J la densité de courant et σ est la conductivité électrique. Le 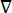 dans l’équation indique un opérateur de gradient. Dans le cas d’un courant stationnaire, les conditions aux limites suivantes sont imposées au modèle:
dans l’équation indique un opérateur de gradient. Dans le cas d’un courant stationnaire, les conditions aux limites suivantes sont imposées au modèle:
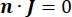
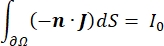
où n est la normale à la surface, Ω représente la frontière, et I0 représente le courant spécifique. Ensemble, ils créent une isolation électrique aux limites extérieures et créent une source de courant pour une limite sélectionnée. Si nous supposons une source ponctuelle monopolaire dans un milieu homogène avec une conductivité isotrope, le potentiel électrique extracellulaire à un endroit arbitraire peut être calculé par7:
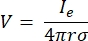
où Ie est le courant et est la distance entre l’électrode et le point de mesure. Lorsque le support est inhomogène ou anisotrope, ou que le réseau d’électrodes comporte plusieurs électrodes, une suite de calcul pour résoudre numériquement les équations peut être pratique. Un logiciel de modélisation par éléments finis6 décompose le conducteur de volume en petites sections appelées « éléments ». Les éléments sont interconnectés les uns avec les autres de sorte que les effets du changement dans un élément influencent le changement dans les autres, et cela résout les équations physiques qui servent à décrire ces éléments. Avec la vitesse de calcul croissante des ordinateurs modernes, ce processus peut être achevé en quelques secondes. Une fois le potentiel électrique calculé, on peut alors estimer la réponse électrique du neurone.
Un neurone envoie et reçoit des informations sous forme de signaux électriques. Ces signaux se présentent sous deux formes: les potentiels gradués et les potentiels d’action. Les potentiels gradués sont des changements temporaires du potentiel de membrane dans lesquels la tension à travers la membrane devient plus positive (dépolarisation) ou négative (hyperpolarisation). Les potentiels gradués ont généralement des effets localisés. Dans les cellules qui les produisent, les potentiels d’action sont des réponses tout ou rien qui peuvent parcourir de longues distances le long d’un axone. Les potentiels gradués et d’action sont sensibles à l’environnement électrique et chimique. Un pic de potentiel d’action peut être produit par divers types de cellules neuronales, y compris les cellules ganglionnaires de la rétine, lorsqu’un seuil de potentiel transmembranaire est franchi. Le pic et la propagation du potentiel d’action déclenchent alors la transmission synaptique des signaux aux neurones en aval. Un neurone peut être modélisé comme un câble divisé en segments cylindriques, où chaque segment a une capacité et une résistance dues à la membrane bicouchelipidique 8. Un programme de calcul neuronal9 peut estimer l’activité électrique d’une cellule électriquement excitable en discrétisant la cellule en plusieurs compartiments et en résolvant le modèle mathématique10:
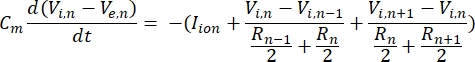
Dans cette équation, Cmest la capacité de la membrane, V e,n est le potentiel extracellulaire au nœud n, Vi,n le potentiel intracellulaire au nœud n, R n la résistance intracellulaire (longitudinale) au nœud n, et Iion est le courant ionique traversant les canaux ioniques au nœud n. Les valeurs de V du modèle FEM sont implémentées sous forme de Ve,n pour tous les nœuds du neurone lorsque la stimulation est active.
Les courants transmembranaires des canaux ioniques peuvent être modélisés à l’aide des formulations de Hodgkin-Huxley11:
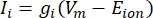
où g i est la conductance spécifique du canal, V m le potentiel transmembranaire (V i,n – Ve,n) et Eion le potentiel d’inversion du canal ionique. Pour les canaux voltage-dépendants, tels que le canal Na, les paramètres sans dimension, m et h, qui décrivent la probabilité d’ouverture ou de fermeture des canaux sont introduits:
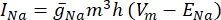
où 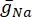 est la conductance maximale de la membrane pour le canal ionique particulier, et les valeurs des paramètres m et h sont définies par des équations différentielles:
est la conductance maximale de la membrane pour le canal ionique particulier, et les valeurs des paramètres m et h sont définies par des équations différentielles:
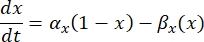
où α x et βx sont des fonctions dépendantes de la tension qui définissent les constantes de vitesse du canal ionique. Elles prennent généralement la forme :
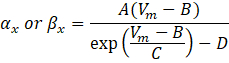
Les valeurs des paramètres de ces équations, y compris la conductance maximale, ainsi que les constantes A, B, C et D, ont généralement été trouvées à partir de mesures empiriques.
Avec ces blocs de construction, des modèles de différentes complexités peuvent être construits en suivant les étapes décrites. Un logiciel FEM est utile lorsque l’équation de Poisson ne peut pas être résolue analytiquement, comme dans le cas d’une conductance inhomogène ou anisotrope dans le conducteur de volume ou lorsque la géométrie du réseau d’électrodes est complexe. Une fois que les valeurs de potentiel extracellulaire ont été résolues, le modèle de câble neuronal peut alors être résolu numériquement dans le logiciel de calcul neuronal. La combinaison des deux logiciels permet le calcul d’une cellule ou d’un réseau neuronal complexe à un champ électrique non uniforme.
Un modèle simple en deux étapes d’une cellule ganglionnaire rétinienne sous stimulation suprachoroïdienne sera construit à l’aide des programmes susmentionnés. Dans cette étude, la cellule ganglionnaire de la rétine sera soumise à une gamme d’amplitudes d’impulsions de courant électrique. L’emplacement de la cellule par rapport au stimulus est également varié pour montrer la relation distance-seuil. De plus, l’étude comprend une validation du résultat de calcul par rapport à une étude in vivo du seuil d’activation corticale utilisant différentes tailles d’électrode de stimulation12, ainsi qu’une étude in vitro montrant la relation entre la distance électrode-neurone et le seuil d’activation13.
Protocol
Representative Results
Discussion
Dans cet article, nous avons démontré un flux de travail de modélisation qui combinait la modélisation par éléments finis et la modélisation des neurones biophysiques. Le modèle est très flexible, car sa complexité peut être modifiée pour s’adapter à différents objectifs, et il fournit un moyen de valider les résultats par rapport aux résultats empiriques. Nous avons également démontré comment nous avons paramétré le modèle pour permettre l’automatisation.
La méthode…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette recherche est financée par la subvention Projet du Conseil national de recherches médicales et de santé (numéro de subvention 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neuroscience. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

