Une approche basée sur la spectrométrie de masse pour identifier les phosphoprotéines phosphatases et leurs interacteurs
Summary
Nous présentons ici un protocole pour l’enrichissement des phosphoprotéines phosphatases endogènes et de leurs protéines en interaction à partir de cellules et de tissus et leur identification et quantification par spectrométrie de masse protéomique.
Abstract
La plupart des processus cellulaires sont régulés par phosphorylation dynamique des protéines. Plus des trois quarts des protéines sont phosphorylées et les phosphoprotéines phosphatases (PPP) coordonnent plus de 90 % de toute la déphosphorylation cellulaire de la sérine/thréonine. La dérégulation de la phosphorylation des protéines a été impliquée dans la physiopathologie de diverses maladies, y compris le cancer et la neurodégénérescence. Malgré leur activité généralisée, les mécanismes moléculaires contrôlant les PPP et ceux contrôlés par les PPP sont mal caractérisés. Ici, une approche protéomique appelée perles inhibitrices de la phosphatase et spectrométrie de masse (PIB-MS) est décrite pour identifier et quantifier les PPP, leurs modifications post-traductionnelles et leurs interacteurs en aussi peu que 12 heures en utilisant n’importe quelle lignée cellulaire ou tissu. PIB-MS utilise un inhibiteur non sélectif du PPP, la microcystine-LR (MCLR), immobilisé sur des billes de sépharose pour capturer et enrichir les PPP endogènes et leurs protéines associées (appelées PPPome). Cette méthode ne nécessite pas l’expression exogène de versions marquées de PPP ni l’utilisation d’anticorps spécifiques. PIB-MS offre un moyen innovant d’étudier les PPP conservés de manière évolutive et d’élargir notre compréhension actuelle de la signalisation de déphosphorylation.
Introduction
La phosphorylation des protéines contrôle la plupart des processus cellulaires, y compris, mais sans s’y limiter, la réponse aux dommages à l’ADN, la signalisation du facteur de croissance et le passage par la mitose 1,2,3. Dans les cellules de mammifères, la majorité des protéines sont phosphorylées à un ou plusieurs résidus de sérine, de thréonine ou de tyrosine à un moment donné, les phosphosérines et les phosphothréonines représentant environ 98 % de tous les sites de phosphorylation 2,3. Alors que les kinases ont été largement étudiées dans la signalisation cellulaire, le rôle des PPP dans la régulation des processus cellulaires dynamiques est encore émergent.
La dynamique de phosphorylation est contrôlée par l’interaction dynamique entre les kinases et les phosphatases. Dans les cellules de mammifères, il existe plus de 400 protéines kinases qui catalysent la phosphorylation de la sérine/thréonine. Plus de 90% de ces sites sont déphosphorylés par les phosphoprotéines phosphatases (PPP), une petite famille d’enzymes composée de PP1, PP2A, PP2B, PP4-7, PPT et PPZ 2,3. PP1 et PP2A sont responsables de la majorité de la déphosphosérine et de la phosphothréonine dans une cellule 2,3,4. La différence notable de nombre entre les kinases et les phosphatases et le manque de spécificité des sous-unités catalytiques PPP in vitro ont conduit à la croyance que les kinases sont le principal déterminant de la phosphorylation 2,3. Cependant, de multiples études ont montré que les phosphatases établissaient la spécificité du substrat par la formation d’holoenzymes multimériques 5,6,7,8,9. Par exemple, PP1 est un hétérodimère constitué d’une sous-unité catalytique et, à un moment donné, d’une des plus de 150 sous-unités régulatrices 6,7,8. Inversement, PP2A est un hétérotrimère formé d’un échafaudage (A), d’une sous-unité régulatrice (B) et d’une sous-unité catalytique (C) 2,3,9. Il existe quatre familles distinctes de sous-unités régulatrices PP2A (B55, B56, PR72 et striatine), chacune avec plusieurs gènes, variantes d’épissure et modèles de localisation 2,3,9. La nature multimérique des PPP comble le manque de kinases et de sous-unités catalytiques PPP. Cependant, cela crée des défis analytiques pour l’étude de la signalisation PPP. Pour analyser de manière exhaustive la signalisation PPP, il est essentiel d’étudier les différentes holoenzymes au sein d’une cellule ou d’un tissu. De grands progrès ont été réalisés dans l’étude du kinome humain grâce à l’utilisation de perles inhibitrices de kinases, appelées perles inhibitrices multiplex ou kinobeads, une stratégie protéomique chimique où les inhibiteurs de kinases sont immobilisés sur des perles et où la spectrométrie de masse est utilisée pour identifier les kinases enrichies et leurs interacteurs 10,11,12,13.
Nous avons établi une approche similaire pour étudier la biologie des PPP. Cette technique implique la capture d’affinité de sous-unités catalytiques PPP à l’aide de billes avec un inhibiteur de PPP non sélectif immobilisé appelé microcystine-LR (MCLR) appelé billes inhibitrices de phosphatase (PIBs)14,15. Contrairement à d’autres méthodes qui nécessitent le marquage endogène ou l’expression de sous-unités PPP exogènes susceptibles de modifier l’activité ou la localisation des protéines, LE PIB-MS permet l’enrichissement des sous-unités catalytiques PPP endogènes, de leurs sous-unités régulatrices et d’échafaudage associées et des protéines en interaction (appelées PPPome) à partir de cellules et de tissus à un moment donné ou dans des conditions de traitement spécifiques. McLR inhibe PP1, PP2A, PP4-6, PPT et PPZ à des concentrations nanomolaires, ce qui rend les PIB très efficaces pour enrichir le PPPome16. Cette méthode peut être mise à l’échelle pour être utilisée sur n’importe quel matériau de départ, des cellules aux échantillons cliniques. Ici, nous décrivons en détail l’utilisation des PIB et de la spectrométrie de masse (PIB-MS) pour capturer, identifier et quantifier efficacement le PPPome endogène et ses états de modification.
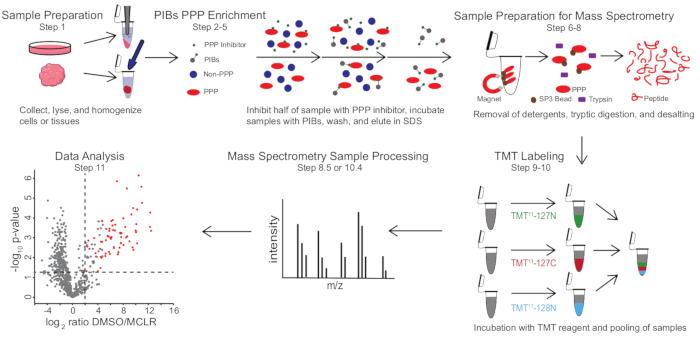
Figure 1 : Résumé visuel du protocole PIB-MS. Dans une expérience PIB-MS, des échantillons peuvent être obtenus sous diverses formes, des cellules aux tumeurs. L’échantillon est collecté, lysé et homogénéisé avant l’enrichissement en PPP. Pour enrichir les PPP, le lysat est incubé avec des PIB avec ou sans inhibiteur de PPP, tel que LE MCLR. Les PIB sont ensuite lavés et les PPP sont élués dans des conditions de dénaturation. Les échantillons sont préparés pour l’analyse par spectrométrie de masse par élimination des détergents par enrichissement en protéines SP3, digestion tryptique et dessalement. Les échantillons peuvent ensuite être éventuellement marqués TMT avant l’analyse par spectrométrie de masse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
PIB-MS implique la lyse et la clarification des cellules ou des tissus, l’incubation du lysat avec des PIB, l’élution et l’analyse de l’éluat via des approches basées sur le transfert occidental ou la spectrométrie de masse (Figure 1). L’ajout de MCLR libre peut être utilisé comme contrôle pour distinguer des liants PIB spécifiques des interacteurs non spécifiques. Pour la plupart des applications, une approche sans étiquette peut être utilisée pour identifier directement les protéines dans les éluats. Dans les cas où une plus grande précision dans la quantification ou l’identification des espèces de faible abondance est nécessaire, un traitement supplémentaire avec l’étiquetage en tandem masse-étiquette (TMT) peut être utilisé pour augmenter la couverture et diminuer les intrants.
Protocol
Representative Results
Discussion
PIB-MS est une approche protéomique chimique utilisée pour profiler quantitativement le PPPome à partir de diverses sources d’échantillons en une seule analyse. Beaucoup de travail a été fait en utilisant des billes inhibitrices de kinase pour étudier le kinome et comment il change dans le cancer et d’autres états pathologiques 10,11,12,13. Pourtant, l’étude du PPPome est à la t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
A.N.K. reconnaît le soutien des NIH R33 CA225458 et R35 GM119455. Nous remercions les laboratoires Kettenbach et Gerber pour leur discussion utile.
Materials
| Acetonitrile (ACN) | Honeywell | AH015-4 | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Anhydrous Acetonitrile | Sigma-Aldrich | 271004-100ML | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Benchtop centrifuge | Eppendorf | model no. 5424 | |
| Beta-glycerophosphoric acid, disodium salt pentahydrate | Acros Organics | 410991000 | |
| Centrifuge | Eppendorf | model no. 5810 R 15 amp version | |
| Distilled water | |||
| DMSO | Fisher Scientific | BP231-100 | |
| Dounce tissue grinder | Fisherbrand Pellet Pestles | 12-141-363 | |
| Empore solid phase extraction disk, C18 | CDS Analytical | 76333-132 | |
| Eppendorf tubes, 1.5 mL | Eppendorf | 22363204 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Eppendorf tubes, 2 mL | Eppendorf | 22363352 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Extraction plate manifold | Waters | WAT097944 | |
| Falcon tubes, 50 mL | VWR | 21008 | |
| Generic blunt end needle and plunger | |||
| Generic magnetic separation rack | |||
| HEPES | Sigma-Aldrich | H3375 | |
| Hydrogen chloride (HCl) | VWR Chemicals BDH | BDH3028 | CAUTION: HCl is corrosive; wear gloves and work in a chemical fume hood. |
| Hydroxylamine solution 50% (wt/vol) | Sigma-Aldrich | 467804 | |
| Incubator, 65 °C | VWR | model no. 1380FM | |
| Koptec Pure Ethanol, 200 Proof | Decon Labs | V1001 | |
| Methanol for HPLC (MeOH) | Sigma-Aldrich | 34860-4L-R | CAUTION: MeOH is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Microcystin LR (MCLR) | Cayman Chemical | 10007188 | CAUTION: MCLR is toxic; wear gloves when handling and avoid skin contact. |
| PBS, 1× without calcium and magnesium, pH 7.4 ± 0.1 | Corning | 21-040-CV | |
| pH test strips, such as MilliporeSigma MColorpHast pH test strips and indicator papers | Fisher Scientific | M1095310001 | |
| PIBs | For protocol for the generation of PIBs, see Moorhead et al., 2007. | ||
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| Pipette tips, 10 μL | Eppendorf | 22491504 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 1000 μL | Eppendorf | 22491555 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 200 μL | Eppendorf | 22491539 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| plastic syringe, 10 mL | BD | 309604 | |
| Protease inhibitor cocktail III | Research Products International | P50700-1 | |
| Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer, Oribtrap Fusion, Orbitrap Fusion Lumos, or Orbitrap Eclipse Tribrid Mass Spectrometer | Thermo Scientific | ||
| Refrigerated benchtop centrifuge | Eppendorf | model no. 5424 R | |
| Rotator (Labquake Shaker Rotisserie) | Thermo Scientific | 13-687-12Q | 8 rpm rotation |
| Sample collection plate, 96- well, 1 mL | Waters | WAT058957 | |
| SDS | Fisher Scientific | BP1311-1 | |
| Sequencing grade modified trypsin | Promega | V511C | |
| Sodium azide | EMD Chemicals | SX0299-1 | CAUTION: Sodium azide is explosive and toxic; wear gloves, work in a chemical fume hood and avoid contact with metals. |
| Sodium chloride (NaCl) | Fisher Chemical | S27110 | |
| Sonicator (Branson digital sonifier) | model no. SFX 250 | ||
| SPE C18 desalting plate | Waters | 186001828BA | |
| SpeedBeads magnetic carboxylate modified particles (SP3 beads) | Cytiva | 6.51521E+13 | |
| Thermomixer | Eppendorf | model no. 5350 | |
| TMT10plex Isobaric Label Reagent Set plus TMT11-131C Label Reagent, 3 × 0.8 mg per tag | ThermoFisher | A37725 | |
| Trifluoroacetic acid (TFA) | Honeywell | T6508-25ML | CAUTION: TFA is corrosive and will irritate skin on contact. Wear gloves and eye protection, and work in a chemical fume hood. |
| Tris Base | Research Products International | T60040 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Vacuum centrifuge and vapor trap | Thermo Scientific | model nos. SpeedVac SPD120 and RVT5105 | |
| Vortexer (Vortex-Genie 2) | Scientific Industries | ||
| Water LC-MS | Honeywell | LC365-4 |
References
- Nilsson, J. Protein phosphatases in the regulation of mitosis. Journal of Cell Biology. 218 (2), 395-409 (2019).
- Brautigan, D. L. Protein Ser/Thr phosphatases–the ugly ducklings of cell signalling. The FEBS Journal. 280 (2), 324-345 (2013).
- Brautigan, D. L., Shenolikar, S. Protein serine/threonine phosphatases: keys to unlocking regulators and substrates. Annual Review of Biochemistry. 87, 921-964 (2018).
- Janssens, V., Goris, J. Protein phosphatase 2A: A highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling. Biochemical Journal. 353, 417-439 (2001).
- Virshup, D. M., Shenolikar, S. From promiscuity to precision: protein phosphatases get a makeover. Molecular Cell. 33 (5), 537-545 (2009).
- Bollen, M., Peti, W., Ragusa, M. J., Beullens, M. The extended PP1 toolkit: designed to create specificity. Trends in Biochemical Sciences. 35 (8), 450-458 (2010).
- Qian, J., Winkler, C., Bollen, M. 4D-networking by mitotic phosphatases. Current Opinion in Cell Biology. 25 (6), 697-703 (2013).
- Heroes, E., et al. The PP1 binding code: a molecular-lego strategy that governs specificity. The FEBS Journal. 280 (2), 584-595 (2013).
- Eichhorn, P. J., Creyghton, M. P., Bernards, R. Protein phosphatase 2A regulatory subunits and cancer. Biochimica et Biophysica Acta. 1795 (1), 1-15 (2009).
- Bantscheff, M., et al. Quantitative chemical proteomics reveals mechanisms of action of clinical ABL kinase inhibitors. Nature Biotechnology. 25 (9), 1035-1044 (2007).
- Klaeger, S., et al. Chemical proteomics reveals ferrochelatase as a common off-target of kinase inhibitors. ACS Chemical Biology. 11 (5), 1245-1254 (2016).
- Duncan, J. S., et al. Dynamic reprogramming of the kinome in response to targeted MEK inhibition in triple-negative breast cancer. Cell. 149 (2), 307-321 (2012).
- Cooper, M. J., et al. Application of multiplexed kinase inhibitor beads to study kinome adaptations in drug-resistant leukemia. PLoS ONE. 8 (6), 66755 (2013).
- Lyons, S. P., et al. A quantitative chemical proteomic strategy for profiling phosphoprotein phosphatases from yeast to humans. Molecular and Cellular Proteomics. 17 (12), 2448-2461 (2018).
- Nasa, I., et al. Quantitative kinase and phosphatase profiling reveal that CDK1 phosphorylates PP2Ac to promote mitotic entry. Science Signaling. 13 (648), (2020).
- Swingle, M., Ni, L., Honkanen, R. E. Small-molecule inhibitors of ser/thr protein phosphatases: specificity, use and common forms of abuse. Methods in Molecular Biology. 365, 23-38 (2007).
- Moorhead, G. B. G., Haystead, T. A. J., MacKintosh, C. Synthesis and use of the protein phosphatase affinity matrices microcystin-sepharose and microcystin-biotin-sepharose. Methods in Molecular Biology. 365, 39-45 (2007).
- Brauer, B. L., Wiredu, K., Mitchell, S., Moorhead, G. B., Gerber, S. A., Kettenbach, A. N. Affinity-based profiling of endogenous phosphoprotein phosphatases by mass spectrometry. Nature Protocols. 16 (10), 4919-4943 (2021).
- Hughes, C. S., Moggridge, S., Müller, T., Sorensen, P. H., Morin, G. B., Krijgsveld, J. Single-pot, solid-phase-enhanced sample preparation for proteomics experiments. Nature Protocols. 14 (1), 68-85 (2019).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature Protocols. 2 (8), 1896-1906 (2007).
- Zecha, J., et al. TMT labeling for the masses: A robust and cost-efficient, in-solution labeling approach. Molecular and Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nature Methods. 4 (3), 207-214 (2007).
- Eng, J. K., Jahan, T. A., Hoopmann, M. R. Comet: an open-source MS/MS sequence database search tool. Proteomics. 13 (1), 22-24 (2013).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Yu, S. H., Ferretti, D., Schessner, J. P., Rudolph, J. D., Borner, G. H. H., Cox, J. Expanding the Perseus software for omics data analysis With custom plugins. Current Protocols in Bioinformatics. 71 (1), 1-29 (2020).

