Screening med hög genomströmning av mikrobiella isolat med inverkan på Caenorhabditis elegans hälsa
Summary
Tarmmikrober kan positivt eller negativt påverka värdens hälsa via specifika eller konserverade mekanismer. Caenorhabditis elegans är en bekväm plattform för att screena för sådana mikrober. Detta protokoll beskriver screening med hög genomströmning av 48 bakterieisolat för påverkan på nematodstressresistens, som används som en proxy för maskhälsa.
Abstract
Med sin lilla storlek, korta livslängd och enkla genetik erbjuder Caenorhabditis elegans en bekväm plattform för att studera effekterna av mikrobiella isolat på värdfysiologin. Det fluorescerar också i blått när det dör, vilket ger ett bekvämt sätt att hitta döden. Denna egenskap har utnyttjats för att utveckla etikettfria C. elegans survival assays (LFASS) med hög genomströmning. Dessa involverar time-lapse fluorescensregistrering av maskpopulationer i multiwellplattor, från vilka populationens mediantid för döden kan härledas. Denna studie antar LFASS-metoden för att screena flera mikrobiella isolat samtidigt för effekterna på C. elegans mottaglighet för svår värme och oxidativa påfrestningar. Sådan mikrobiell screening pipeline, som särskilt kan användas för att prescreena probiotika, med hjälp av svår stressresistens som en proxy för värd hälsa rapporteras här. Protokollet beskriver hur man odlar både C. elegans tarmmikrobiota-isolatsamlingar och synkrona maskpopulationer i multiwell-arrays innan de kombineras för analyserna. Exemplet som tillhandahålls omfattar testning av 47 bakterieisolat och en kontrollstam på två maskstammar, i två stressanalyser parallellt. Tillvägagångssättspipelinen är dock lätt skalbar och tillämplig på screening av många andra metoder. Således ger det en mångsidig inställning för att snabbt kartlägga ett multiparametriskt landskap av biologiska och biokemiska förhållanden som påverkar C. elegans hälsa.
Introduction
Människokroppen har uppskattningsvis 10-100 biljoner levande mikrobiella celler (bakterier, archaea-svampar), som främst finns i tarm-, hud- och slemhinnemiljöerna1. I ett hälsosamt tillstånd ger dessa fördelar för sin värd, inklusive vitaminproduktion, mognad av immunsystemet, stimulering av medfödda och adaptiva immunsvar mot patogener, reglering av fettmetabolism, modulering av stressreaktioner och mer, med inverkan på tillväxt och utveckling, sjukdomsdebut och åldrande 2,3,4,5 . Tarmmikrobiotan utvecklas också avsevärt under hela livet. Den mest drastiska utvecklingen sker under spädbarn och tidig barndom6, men betydande förändringar sker också med åldern, inklusive en minskning av Bifidobacterium överflöd och en ökning av Clostridium, Lactobacillus, Enterobacteriaceae, och Enterococcus arter7. Livsstil kan ytterligare förändra tarmens mikrobiella sammansättning som leder till dysbios (förlust av fördelaktiga bakterier, överväxt av opportunistiska bakterier), vilket resulterar i olika patologier som inflammatorisk tarmsjukdom, diabetes och fetma5, men också bidrar till Alzheimers och Parkinsons sjukdomar 8,9,10,11.
Denna insikt har kritiskt bidragit till att förfina begreppet tarm-hjärnaxeln (GBA), där interaktioner mellan tarmfysiologi (nu inklusive mikroberna i den) och nervsystemet anses vara den viktigaste regulatorn för djurmetabolism och fysiologiska funktioner12. Emellertid, den exakta rollen av mikrobiota i tarm-hjärna signalering och de associerade verkningsmekanismerna är långt ifrån helt förstådd13. Med tarmmikrobiota som en viktig determinant för hälsosamt åldrande har hur bakterier modulerar åldringsprocessen blivit föremål för intensiv forskning och kontrovers 6,14,15.
Med demonstrationen att rundmask Caenorhabditis elegans är värd för en bonafide tarmmikrobiota dominerad-som i andra arter-av Bacteroidetes, Firmicutes och Actinobacteria 16,17,18,19,20, dess snabba uppgång som en experimentell plattform för att studera värd-tarm kommensala interaktioner 21,22,23,24 ,25,26 har avsevärt utökat vår utredningsarsenal26,27,28,29. I synnerhet kan experimentella metoder med hög genomströmning tillgängliga för C. elegans för att studera gen-diet, gen-läkemedel, gen-patogen, etc. interaktioner, anpassas för att snabbt utforska hur bakterieisolat och cocktails påverkar C. elegans hälsa och åldrande.
Detta protokoll beskriver en experimentell pipeline för att på en gång screena arrays av bakterieisolat eller blandningar som sätts i multiwell plattor för effekter på C. elegans stressresistens som en proxy för hälsa, som kan användas för att identifiera probiotika. Den beskriver hur man odlar stora maskpopulationer och hanterar bakteriella arrayer i 96- och 384-brunnsplattformat innan man bearbetar maskar för automatiserad stressmotståndsanalys med hjälp av en fluorescensplattläsare (figur 1). Tillvägagångssättet bygger på etikettfria automatiserade överlevnadsanalyser (LFASS)30 som utnyttjar fenomenet dödsfluorescens31, där döende maskar producerar en explosion av blå fluorescens som kan användas för att fastställa dödstiden. Blå fluorescens avges av glukosylestrar av anthranilsyra lagrade i C. elegans tarmgranulat (en typ av lysosomrelaterad organell), som spricker när en nekrotisk kaskad utlöses i masktarmen vid döden31.
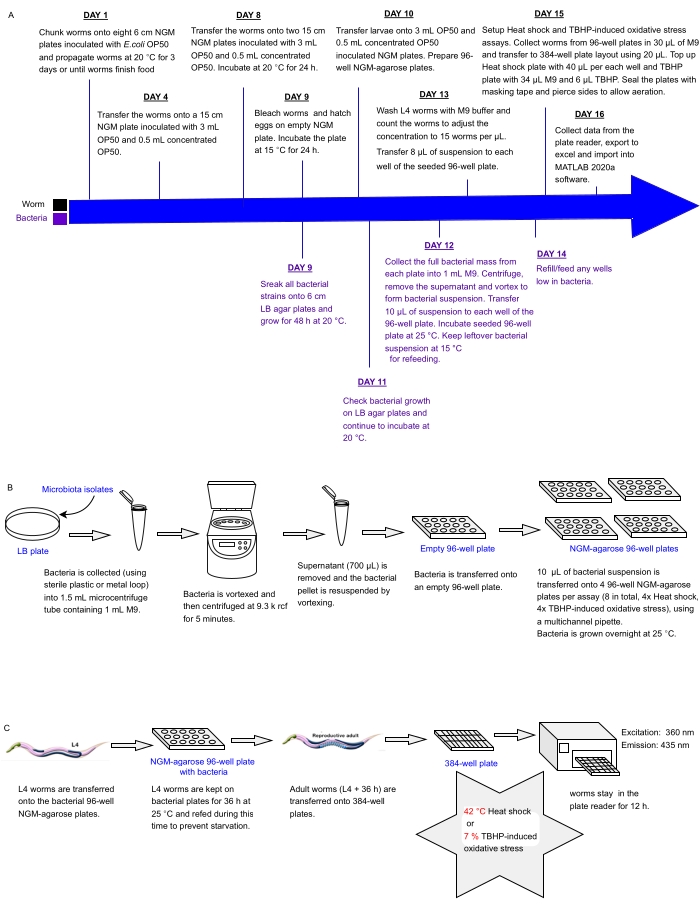
Figur 1: Experimentellt arbetsflöde för screening med hög genomströmning av bakterieisolat med inverkan på C. elegans motståndskraft mot stress . (A) Tidslinje för underhåll och analys av mask och bakterier. (B) Installation och hantering av bakterieplattor med 96 brunnar. (C) Installation av maskplattor med 384 brunnar. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
C. elegans erbjuder många fördelar för att snabbt screena flera experimentella parametrar samtidigt, på grund av dess lilla storlek, transparens, snabba utveckling, korta livslängd, billighet och enkel hantering. Dess betydligt enklare genom, kroppsplan, nervsystem, tarm och mikrobiom, men ändå komplexa och tillräckligt lika människor, gör det till en kraftfull preklinisk modell, där mekanistisk insikt kan uppnås när man testar för bioaktiv effekt eller toxicitet. Eftersom intresset växer för att…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar CGC Minnesota (Madison, USA, NIH – P40 OD010440) för att tillhandahålla maskstammar och OP50 och Pr. Hinrich Schulenburg (CAU, Kiel, Tyskland) för att tillhandahålla alla miljömikrobiella isolat som visas här. Detta arbete finansierades av ett UKRI-BBSRC-bidrag till AB (BB/S017127/1). JM finansieras av ett doktorandstipendium från Lancaster University FHM.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
References
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

