Multi-Stream Perfusion Bioreactor Integreret med Udløbsfraktionering til dynamisk cellekultur
Summary
Dette papir præsenterer en metode til at konstruere og drive et billigt, multikanals perfusionscellekultursystem til måling af dynamikken i sekretion og absorptionshastigheder for opløste stoffer i cellulære processer. Systemet kan også udsætte celler for dynamiske stimulusprofiler.
Abstract
Visse celle- og vævsfunktioner fungerer inden for den dynamiske tidsskala på minutter til timer, der er dårligt løst af konventionelle kultursystemer. Dette arbejde har udviklet et billigt perfusionsbioreaktorsystem, der gør det muligt for kulturmedium kontinuerligt at blive perfunderet i et cellekulturmodul og fraktioneret i et downstream-modul for at måle dynamik på denne skala. Systemet er konstrueret næsten udelukkende fra kommercielt tilgængelige dele og kan paralleliseres til at udføre uafhængige eksperimenter i konventionelle multi-well cellekulturplader samtidigt. Denne videoartikel demonstrerer, hvordan man monterer basisopsætningen, som kun kræver en enkelt multikanals sprøjtepumpe og en modificeret fraktionsopsamler for at gennemskue op til seks kulturer parallelt. Nyttige varianter på det modulære design præsenteres også, der giver mulighed for kontrolleret stimuleringsdynamik, såsom opløste impulser eller farmakokinetiske profiler. Det er vigtigt, at når opløste signaler bevæger sig gennem systemet, forvrænges de på grund af opløst dispersion. Desuden beskrives en metode til måling af opholdstidsfordelingerne (RTD’er) for komponenterne i perfusionsopsætningen med et sporstof ved hjælp af MATLAB. RTD’er er nyttige til at beregne, hvordan opløste signaler forvrænges af strømmen i multirumssystemet. Dette system er meget robust og reproducerbart, så grundlæggende forskere nemt kan vedtage det uden behov for specialiserede fabrikationsfaciliteter.
Introduction
Mange vigtige biologiske processer forekommer i celle- og vævskulturer på tidsskalaen minutter til timer 1,2,3. Mens nogle af disse fænomener kan observeres og registreres på en automatiseret måde ved hjælp af time-lapse mikroskopi4, bioluminescens1 eller andre metoder, udføres eksperimenter, der involverer indsamling af kultursupernatantprøver til kemisk analyse, ofte manuelt i statiske cellekulturer. Manuel prøveudtagning begrænser gennemførligheden af visse undersøgelser på grund af ulemperne ved hyppige eller efter-timers prøveudtagningstidspunkter. Yderligere mangler ved statiske dyrkningsmetoder omfatter eksperimenter, der involverer kontrollerede, forbigående eksponeringer for kemiske stimuli. I statiske kulturer skal stimuli tilføjes og fjernes manuelt, og stimulusprofiler er begrænset til trinændringer over tid, mens mellemstore ændringer også tilføjer og fjerner andre mediumkomponenter, som kan påvirke celler på en ukontrolleret måde5. Fluidiske systemer kan overvinde disse udfordringer, men eksisterende enheder udgør andre udfordringer. Mikrofluidiske enheder leveres med de uoverkommelige omkostninger ved specialudstyr og træning til at producere og bruge, kræver mikroanalytiske metoder til at behandle prøver, og celler er vanskelige at genvinde fra enhederne efter perfusion6. Få makrofluidiske systemer er blevet oprettet til de typer eksperimenter, der er beskrevet her 7,8,9,10, og de er bygget af flere brugerdefinerede dele fremstillet internt og kræver flere pumper eller fraktionsopsamlere. Desuden er forfatterne ikke bekendt med andre kommercielt tilgængelige makrofluidiske perfusionscellekultursystemer end omrørte tankbioreaktorer til suspensionskultur, som er nyttige til biofremstilling, men ikke er designet til modellering og undersøgelse af fysiologi.
Forfatterne har tidligere rapporteret om designet af et billigt perfusionsbioreaktorsystem, der næsten udelukkende består af kommercielt tilgængelige dele11. Basisversionen af systemet gør det muligt at opbevare flere kulturer i en brøndplade i en CO2 -inkubator og kontinuerligt perfunderes med medium fra en sprøjtepumpe, mens spildevandsmediet strømme fra kulturerne automatisk fraktioneres i prøver over tid ved hjælp af en fraktionsopsamler med en brugerdefineret modifikation. Dette system muliggør således automatiseret prøveudtagning af kulturmedium supernatant og kontinuerlig opløst stof input til kulturerne over tid. Systemet er makrofluidisk og modulært og kan let ændres for at imødekomme behovene i nye eksperimentdesign.
Det overordnede mål med den metode, der præsenteres her, er at konstruere, karakterisere og anvende et perfusionscellekultursystem, der muliggør eksperimenter, hvor cellernes sekretion eller absorptionshastigheder af stoffer over tid måles, og / eller celler udsættes for præcise, forbigående opløste signaler. Denne videoartikel forklarer, hvordan man samler basisopsætningen, som er i stand til at gennemsyre op til seks cellekulturer samtidigt ved hjælp af en enkelt sprøjtepumpe og modificeret fraktionsopsamler. To nyttige varianter af basissystemet, der gør brug af yderligere pumper og dele for at muliggøre forsøg, der udsætter celler for forbigående koncentrationssignaler fra opløst stof, herunder korte impulser og farmakokinetiske profiler12, præsenteres også, vist i figur 1.
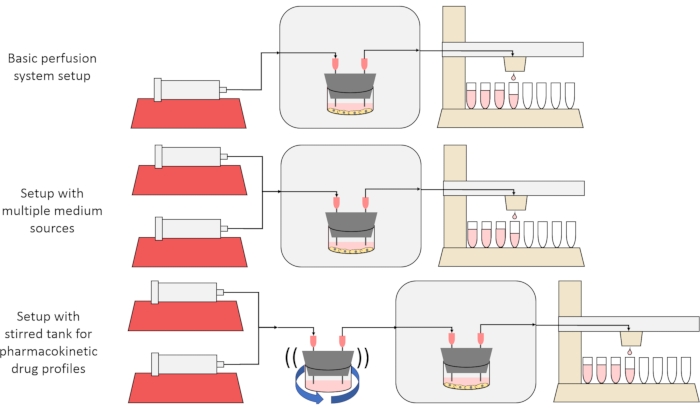
Figur 1: Tre variationer af perfusionssystemets design. (Øverst) Det grundlæggende perfusionssystem. (I midten) Perfusionssystemet med en stophane til flere mellemstore kilder. (Nederst) Perfusionssystemet med en omrørt tank for at efterligne et godt blandet fordelingsvolumen. Klik her for at se en større version af denne figur.
På grund af spredning og diffusion i strømmen bliver de opløste signaler forvrænget eller “smurt”, når de bevæger sig gennem strømningssystemet. Denne fordrejning kan kvantificeres ved hjælp af opholdstidsfordelinger (FTU)13. Denne artikel forklarer, hvordan man udfører sporingseksperimenter på komponenter i perfusionssystemet (figur 2), og indeholder MATLAB-scripts til at generere RTD’er fra målte data. En detaljeret forklaring på denne analyse findes i forfatternes tidligere artikel11. Yderligere MATLAB-scripts passer passende funktioner til RTD’erne og udtrækker fysiske parametre og udfører signalkonvolution ved hjælp af RTD’er for at forudsige, hvordan brugerens input af opløst stofsignal vil formere sig og forvrænge gennem perfusionssystemet14.
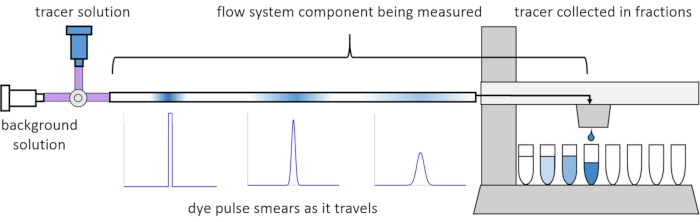
Figur 2: Fordeling af opholdstid. RTD’erne for flowsystemkomponenter, såsom denne slangelængde, måles ved at indtaste en puls af sporstof til systemet og måle, hvordan det “udtværes”, når det kommer ud i de opsamlede fraktioner. Dette tal er blevet ændret fra Erickson et al.11. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Dette arbejde beskriver samlingen og driften af et perfusionscellekultursystem med flere mediumkilder demonstreret med et specifikt eksempel, hvor dynamikken i NF-κB-drevet genekspression som reaktion på en forbigående puls af TNF-α blev målt. RTD’erne for perfusionssystemkomponenterne blev målt og modelleret, og signalkonvolution blev brugt til at forudsige både cellernes eksponering for TNF-α pulsen og TNF-α fordelingen i de opsamlede spildevandsmediumfraktioner. Cellerne blev udsat for pulsen, og fraktioner b…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev udført med støtte under tilskudsnr. R01EB012521, R01EB028782 og T32 GM008339 fra National Institutes of Health.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

