Multi-Stream Perfusion Bioreactor geïntegreerd met Outlet Fractionation voor dynamische celcultuur
Summary
Dit artikel presenteert een methode om een goedkoop, meerkanaals perfusiecelkweeksysteem te construeren en te gebruiken voor het meten van de dynamiek van secretie en absorptiesnelheden van opgeloste stoffen in cellulaire processen. Het systeem kan cellen ook blootstellen aan dynamische stimulusprofielen.
Abstract
Bepaalde cel- en weefselfuncties werken binnen de dynamische tijdschaal van minuten tot uren die slecht worden opgelost door conventionele kweeksystemen. Dit werk heeft een goedkoop perfusiebioreactorsysteem ontwikkeld waarmee kweekmedium continu kan worden doordrenkt in een celkweekmodule en gefractioneerd in een downstream-module om de dynamiek op deze schaal te meten. Het systeem is bijna volledig opgebouwd uit in de handel verkrijgbare onderdelen en kan worden geparallelliseerd om tegelijkertijd onafhankelijke experimenten uit te voeren in conventionele multi-well celkweekplaten. Dit videoartikel demonstreert hoe de basisopstelling moet worden samengesteld, waarvoor slechts een enkele meerkanaals spuitpomp en een gemodificeerde fractiecollector nodig zijn om tot zes culturen parallel te laten doordringen. Er worden ook nuttige varianten op het modulaire ontwerp gepresenteerd die een gecontroleerde stimulatiedynamiek mogelijk maken, zoals opgeloste pulsen of farmacokinetisch-achtige profielen. Belangrijk is dat als opgeloste signalen door het systeem reizen, ze worden vervormd als gevolg van opgeloste dispersie. Verder wordt een methode beschreven voor het meten van de verblijftijdverdelingen (RTD’s) van de componenten van de perfusieopstelling met behulp van MATLAB. RTD’s zijn nuttig om te berekenen hoe opgeloste signalen worden vervormd door de stroom in het systeem met meerdere compartimenten. Dit systeem is zeer robuust en reproduceerbaar, zodat basisonderzoekers het gemakkelijk kunnen gebruiken zonder dat er gespecialiseerde fabricagefaciliteiten nodig zijn.
Introduction
Veel belangrijke biologische processen vinden plaats in cel- en weefselculturen op de tijdschaal van minuten tot uren 1,2,3. Hoewel sommige van deze verschijnselen op een geautomatiseerde manier kunnen worden waargenomen en vastgelegd met behulp van time-lapse microscopie4, bioluminescentie1 of andere methoden, worden experimenten met het verzamelen van cultuursupernatantmonsters voor chemische analyse vaak handmatig uitgevoerd in statische celculturen. Handmatige bemonstering beperkt de haalbaarheid van bepaalde onderzoeken vanwege het ongemak van frequente of na sluitingstijdstips. Verdere tekortkomingen van statische kweekmethoden omvatten experimenten met gecontroleerde, voorbijgaande blootstelling aan chemische stimuli. In statische culturen moeten stimuli handmatig worden toegevoegd en verwijderd, en stimulusprofielen zijn beperkt tot stapsgewijze veranderingen in de loop van de tijd, terwijl mediumveranderingen ook andere mediumcomponenten toevoegen en verwijderen, die cellen op een ongecontroleerde manier kunnen beïnvloeden5. Fluidic-systemen kunnen deze uitdagingen overwinnen, maar bestaande apparaten stellen andere uitdagingen. Microfluïdische apparaten komen met de onbetaalbare kosten van gespecialiseerde apparatuur en training om te produceren en te gebruiken, vereisen microanalytische methoden om monsters te verwerken en cellen zijn moeilijk te herstellen van de apparaten na perfusie6. Er zijn weinig macrofluïdische systemen gemaakt voor de soorten experimenten die hier worden beschreven 7,8,9,10, en ze zijn gebouwd van meerdere aangepaste onderdelen die in eigen huis zijn gemaakt en vereisen meerdere pompen of fractiecollectoren. Bovendien zijn de auteurs niet op de hoogte van commercieel verkrijgbare macrofluïdische perfusiecelkweeksystemen anders dan geroerde tankbioreactoren voor suspensiecultuur, die nuttig zijn voor biomanufacturing, maar niet zijn ontworpen voor het modelleren en bestuderen van fysiologie.
De auteurs rapporteerden eerder over het ontwerp van een goedkoop perfusiebioreactorsysteem dat bijna volledig bestaat uit in de handel verkrijgbare delen11. De basisversie van het systeem maakt het mogelijk om meerdere culturen in een putplaat in een CO2-incubator te bewaren en continu te doordrenken met medium van een spuitpomp, terwijl de effluentmediumstromen uit de culturen in de loop van de tijd automatisch in monsters worden gefractioneerd met behulp van een fractiecollector met een aangepaste modificatie. Dit systeem maakt dus geautomatiseerde bemonstering van kweekmedium supernatant en continue opgeloste input naar de culturen in de loop van de tijd mogelijk. Het systeem is macrofluïdisch en modulair en kan eenvoudig worden aangepast aan de behoeften van nieuwe experimentontwerpen.
Het algemene doel van de hier gepresenteerde methode is om een perfusiecelkweeksysteem te construeren, karakteriseren en gebruiken dat experimenten mogelijk maakt waarbij de secretie- of absorptiesnelheden van stoffen door cellen in de loop van de tijd worden gemeten en / of cellen worden blootgesteld aan nauwkeurige, voorbijgaande opgeloste signalen. In dit videoartikel wordt uitgelegd hoe u de basisopstelling samenstelt, die in staat is om tot zes celculturen tegelijkertijd te perfuseren met behulp van een enkele spuitpomp en een gemodificeerde fractiecollector. Twee nuttige varianten op het basissysteem die gebruik maken van extra pompen en onderdelen om experimenten mogelijk te maken die cellen blootstellen aan voorbijgaande opgeloste concentratiesignalen, waaronder korte pulsen en farmacokinetisch-achtige profielen12, worden ook gepresenteerd, weergegeven in figuur 1.
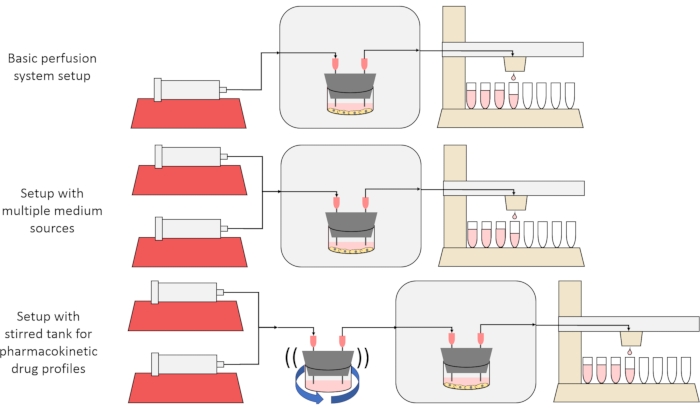
Figuur 1: Drie variaties op het ontwerp van het perfusiesysteem. (Boven) Het basisperfusiesysteem. (Midden) Het perfusiesysteem met een stopkraan voor meerdere mediumbronnen. (Onder) Het perfusiesysteem met een geroerde tank om een goed gemengd distributievolume na te bootsen. Klik hier om een grotere versie van deze figuur te bekijken.
Door dispersie en diffusie binnen de stroming worden de opgeloste signalen vervormd of “besmeurd” terwijl ze door het stromingssysteem reizen. Deze vervorming kan worden gekwantificeerd door het gebruik van verblijftijdverdelingen (OTO’s)13. In dit artikel wordt uitgelegd hoe tracerexperimenten kunnen worden uitgevoerd op onderdelen van het perfusiesysteem (afbeelding 2) en worden MATLAB-scripts gebruikt om RTD’s te genereren op basis van gemeten gegevens. Een gedetailleerde uitleg van deze analyse is te vinden in het vorige artikel11 van de auteurs. Aanvullende MATLAB-scripts passen geschikte functies toe aan de RTD’s en extraheren fysieke parameters, en voeren signaalconvolutie uit met behulp van RTD’s om te voorspellen hoe opgeloste signaalinvoer door de gebruiker zich zal verspreiden en vervormen door het perfusiesysteem14.
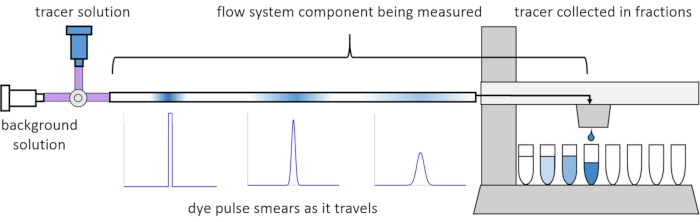
Figuur 2: Verblijftijdverdelingen. De RTD’s van componenten van het stromingssysteem, zoals deze lengte van de buizen, worden gemeten door een puls tracer in het systeem in te voeren en te meten hoe het “uitstrijkt” tegen de tijd dat het de verzamelde fracties verlaat. Dit cijfer is aangepast van Erickson et al.11. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Dit werk beschrijft de assemblage en werking van een perfusiecelkweeksysteem met meerdere mediumbronnen aangetoond met een specifiek voorbeeld waarin de dynamiek van NF-κB-gedreven genexpressie als reactie op een voorbijgaande puls van TNF-α werd gemeten. De RTD’s van de componenten van het perfusiesysteem werden gemeten en gemodelleerd, en signaalconvolutie werd gebruikt om zowel de blootstelling van de cellen aan de TNF-α-puls als de TNF-α-verdeling in de verzamelde effluentmediumfracties te voorspellen. De cellen …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek is uitgevoerd met steun onder Grant Nos. R01EB012521, R01EB028782 en T32 GM008339 van de National Institutes of Health.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

