Bioreattore di perfusione multi-stream integrato con frazionamento in uscita per colture cellulari dinamiche
Summary
Questo documento presenta un metodo per costruire e gestire un sistema di coltura cellulare a perfusione multicanale a basso costo per misurare la dinamica dei tassi di secrezione e assorbimento dei soluti nei processi cellulari. Il sistema può anche esporre le cellule a profili di stimolo dinamici.
Abstract
Alcune funzioni cellulari e tissutali operano all’interno della scala temporale dinamica da minuti a ore che sono scarsamente risolte dai sistemi di coltura convenzionali. Questo lavoro ha sviluppato un sistema di bioreattori a perfusione a basso costo che consente di perfondere continuamente il terreno di coltura in un modulo di coltura cellulare e frazionato in un modulo a valle per misurare la dinamica su questa scala. Il sistema è costruito quasi interamente da parti disponibili in commercio e può essere parallelizzato per condurre esperimenti indipendenti in piastre di coltura cellulare multi-pozzo convenzionali contemporaneamente. Questo articolo video illustra come assemblare la configurazione di base, che richiede solo una singola pompa a siringa multicanale e un collettore di frazioni modificato per perfondere fino a sei colture in parallelo. Vengono inoltre presentate varianti utili sul design modulare che consentono dinamiche di stimolazione controllate, come impulsi di soluto o profili simili a farmacocinetici. È importante sottolineare che, poiché i segnali dei soluti viaggiano attraverso il sistema, vengono distorti a causa della dispersione del soluto. Inoltre, viene descritto un metodo per misurare le distribuzioni del tempo di residenza (RTD) dei componenti della configurazione della perfusione con un tracciante utilizzando MATLAB. Gli RTD sono utili per calcolare come i segnali dei soluti sono distorti dal flusso nel sistema multi-compartimento. Questo sistema è altamente robusto e riproducibile, quindi i ricercatori di base possono facilmente adottarlo senza la necessità di strutture di fabbricazione specializzate.
Introduction
Molti importanti processi biologici si verificano in colture cellulari e tissutali sulla scala temporale da minuti a ore 1,2,3. Mentre alcuni di questi fenomeni possono essere osservati e registrati in modo automatizzato utilizzando la microscopia time-lapse4, la bioluminescenza1 o altri metodi, gli esperimenti che coinvolgono la raccolta di campioni di surnatante di coltura per l’analisi chimica vengono spesso eseguiti manualmente in colture cellulari statiche. Il campionamento manuale limita la fattibilità di alcuni studi a causa dell’inconveniente di punti temporali di campionamento frequenti o fuori orario. Ulteriori carenze dei metodi di coltura statica includono esperimenti che coinvolgono esposizioni controllate e transitorie a stimoli chimici. Nelle colture statiche, gli stimoli devono essere aggiunti e rimossi manualmente, e i profili di stimolo sono limitati ai cambiamenti di passo nel tempo, mentre i cambiamenti medi aggiungono e rimuovono anche altri componenti del mezzo, che possono influenzare le cellule in modo incontrollato5. I sistemi fluidici possono superare queste sfide, ma i dispositivi esistenti pongono altre sfide. I dispositivi microfluidici comportano i costi proibitivi di attrezzature specializzate e formazione da produrre e utilizzare, richiedono metodi microanalitici per elaborare i campioni e le cellule sono difficili da recuperare dai dispositivi dopo la perfusione6. Pochi sistemi macrofluidici sono stati creati per i tipi di esperimenti qui descritti 7,8,9,10, e sono costruiti con più parti personalizzate realizzate internamente e richiedono più pompe o collettori di frazioni. Inoltre, gli autori non sono a conoscenza di alcun sistema di coltura cellulare a perfusione macrofluidica disponibile in commercio diverso dai bioreattori a serbatoi agitati per la coltura in sospensione, che sono utili per la bioproduzione, sebbene non siano progettati per modellare e studiare la fisiologia.
Gli autori hanno precedentemente riferito sulla progettazione di un sistema di bioreattori a perfusione a basso costo composto quasi interamente da parti11 disponibili in commercio. La versione base del sistema consente di conservare più colture in una piastra di pozzo in un incubatore a CO2 e di fondere continuamente con il mezzo di una pompa a siringa, mentre i flussi del mezzo effluente provenienti dalle colture vengono automaticamente frazionati in campioni nel tempo utilizzando un collettore di frazioni con una modifica personalizzata. Pertanto, questo sistema consente il campionamento automatizzato del surnatante del terreno di coltura e l’input continuo del soluto alle colture nel tempo. Il sistema è macrofluidico e modulare e può essere facilmente modificato per soddisfare le esigenze di nuovi progetti di esperimenti.
L’obiettivo generale del metodo qui presentato è quello di costruire, caratterizzare e utilizzare un sistema di coltura cellulare a perfusione che consenta esperimenti in cui vengono misurati i tassi di secrezione o assorbimento di sostanze da parte delle cellule nel tempo e / o le cellule sono esposte a segnali di soluto precisi e transitori. Questo articolo video spiega come assemblare la configurazione di base, che è in grado di perfondere fino a sei colture cellulari contemporaneamente utilizzando una singola pompa a siringa e un collettore di frazioni modificate. Nella Figura 1 sono inoltre presentate due varianti utili sul sistema di base che utilizzano pompe e parti aggiuntive per consentire esperimenti che espongono le cellule a segnali transitori di concentrazione di soluto, inclusi brevi impulsi e profili farmacocinetici12.
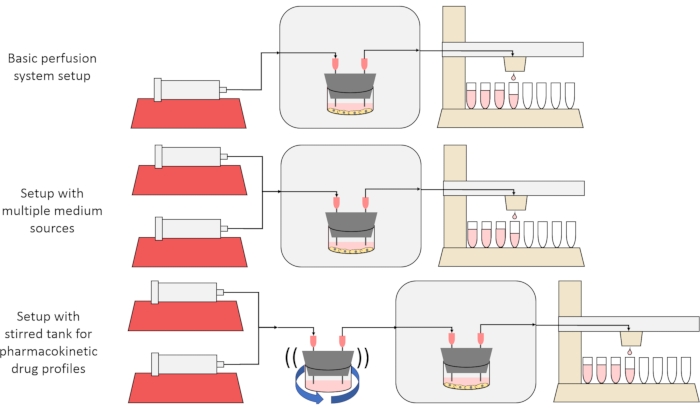
Figura 1: Tre variazioni sul progetto del sistema di perfusione. (In alto) Il sistema di perfusione di base. (Al centro) Il sistema di perfusione con un rubinetto di arresto per più sorgenti medie. (In basso) Il sistema di perfusione con un serbatoio agitato per imitare un volume di distribuzione ben miscelato. Fare clic qui per visualizzare una versione più grande di questa figura.
A causa della dispersione e della diffusione all’interno del flusso, i segnali del soluto diventano distorti o “imbrattati” mentre viaggiano attraverso il sistema di flusso. Questa distorsione può essere quantificata mediante l’uso di distribuzioni temporali di residenza (RTD)13. Questo articolo spiega come eseguire esperimenti traccianti sui componenti del sistema di perfusione (Figura 2) e fornisce script MATLAB per generare RTD dai dati misurati. Una spiegazione dettagliata di questa analisi può essere trovata nel precedente articolo11 degli autori. Ulteriori script MATLAB adattano funzioni appropriate agli RTD ed estraggono parametri fisici ed eseguono la convoluzione del segnale utilizzando RTD per prevedere come l’input del segnale di soluto da parte dell’utente si propagherà e si distorcerà attraverso il sistema di perfusione14.
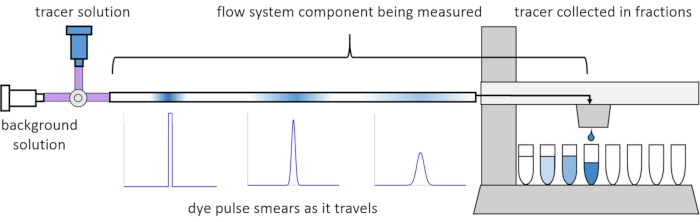
Figura 2: Distribuzioni del tempo di residenza. Gli RTD dei componenti del sistema di flusso, come questa lunghezza del tubo, vengono misurati immettendo un impulso di tracciante nel sistema e misurando come “spalma” nel momento in cui esce nelle frazioni raccolte. Questa cifra è stata modificata da Erickson et al.11. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Questo lavoro descrive l’assemblaggio e il funzionamento di un sistema di coltura cellulare a perfusione con più sorgenti medie dimostrate con un esempio specifico in cui sono state misurate le dinamiche dell’espressione genica guidata da NF-κB in risposta a un impulso transitorio di TNF-α. Gli RTD dei componenti del sistema di perfusione sono stati misurati e modellati e la convoluzione del segnale è stata utilizzata per prevedere sia l’esposizione delle cellule all’impulso TNF-α sia la distribuzione TNF-α nelle f…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata condotta con il supporto di Grant Nos. R01EB012521, R01EB028782 e T32 GM008339 del National Institutes of Health.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

