ביוריאקטור פרפוזיה מרובה זרמים משולב עם פיצול מוצא לתרבית תאים דינמית
Summary
מאמר זה מציג שיטה לבנייה והפעלה של מערכת תרבית תאים רב-ערוצית רב-ערוצית בעלות נמוכה למדידת הדינמיקה של הפרשה וקצבי ספיגה של מומסים בתהליכים תאיים. המערכת יכולה גם לחשוף תאים לפרופילי גירוי דינמיים.
Abstract
תפקודים מסוימים של תאים ורקמות פועלים בסולם הזמן הדינמי של דקות עד שעות שנפתרות בצורה גרועה על ידי מערכות תרביות קונבנציונליות. עבודה זו פיתחה מערכת ביוריאקטורים של פרפוזיה בעלות נמוכה המאפשרת להחדיר את מדיום התרבית באופן רציף למודול תרבית תאים ולפצל אותו במודול במורד הזרם כדי למדוד דינמיקה בקנה מידה זה. המערכת בנויה כמעט כולה מחלקים זמינים מסחרית וניתן להקביל אותה כדי לערוך ניסויים עצמאיים בלוחות תרבית תאים קונבנציונליים מרובי בארות בו זמנית. מאמר וידאו זה מדגים כיצד להרכיב את מערך הבסיס, הדורש רק משאבת מזרק רב-ערוצית אחת ואספן שברים שונה כדי להחדיר עד שש תרבויות במקביל. כמו כן, מוצגות גרסאות שימושיות על העיצוב המודולרי המאפשרות דינמיקת גירוי מבוקרת, כגון פולסים מומסים או פרופילים דמויי פרמקוקינטיים. חשוב לציין, כאשר אותות מומסים נעים במערכת, הם מעוותים עקב פיזור מומס. יתר על כן, מתוארת שיטה למדידת התפלגויות זמן המגורים (RTDs) של רכיבי הגדרת הזלוף באמצעות עקיבה באמצעות MATLAB. RTDs שימושיים לחישוב האופן שבו אותות מומסים מעוותים על ידי הזרימה במערכת מרובת התאים. מערכת זו חזקה מאוד וניתנת לשחזור, כך שחוקרים בסיסיים יכולים לאמץ אותה בקלות ללא צורך במתקני ייצור מיוחדים.
Introduction
תהליכים ביולוגיים חשובים רבים מתרחשים בתרביות תאים ורקמות על ציר הזמן של דקות עדשעות 1,2,3. בעוד שחלק מהתופעות הללו עשויות להיות נצפות ומתועדות באופן אוטומטי באמצעות מיקרוסקופיה בהילוך מהיר4, ביולומינסנציה1 או שיטות אחרות, ניסויים הכוללים איסוף דגימות-על של תרביות לצורך אנליזה כימית מבוצעים לעתים קרובות באופן ידני בתרביות תאים סטטיות. דגימה ידנית מגבילה את ההיתכנות של מחקרים מסוימים בשל אי הנוחות של נקודות זמן דגימה תכופות או לאחר שעות העבודה. חסרונות נוספים של שיטות תרבית סטטיות כוללים ניסויים הכוללים חשיפות מבוקרות וחולפות לגירויים כימיים. בתרביות סטטיות, יש להוסיף ולהסיר גירויים באופן ידני, ופרופילי הגירוי מוגבלים לשינויי צעדים לאורך זמן, בעוד ששינויים בינוניים גם מוסיפים ומסירים רכיבים בינוניים אחרים, שיכולים להשפיע על תאים באופן בלתי מבוקר5. מערכות נוזליות יכולות להתגבר על אתגרים אלה, אך מכשירים קיימים מציבים אתגרים אחרים. התקנים מיקרופלואידיים מגיעים עם העלויות הגבוהות של ציוד מיוחד והכשרה לייצור ושימוש, דורשים שיטות מיקרואנליטיות לעיבוד דגימות, ותאים קשים להתאושש מהמכשירים לאחר זלוף6. מעט מערכות מקרופלואידיות נוצרו עבור סוגי הניסויים המתוארים כאן 7,8,9,10, והן בנויות ממספר חלקים מותאמים אישית המיוצרים בתוך הבית ודורשים משאבות מרובות או אספני שברים. יתר על כן, המחברים אינם מודעים למערכות תרביות תאי פרפוזיה מקרופלואידיות הזמינות באופן מסחרי, למעט ביוריאקטורים של מיכלים מעורבבים לתרבית השעיה, אשר שימושיים לייצור ביולוגי, אם כי אינם מיועדים למידול וחקר פיזיולוגיה.
המחברים דיווחו בעבר על תכנון של מערכת ביוריאקטור פרפוזיה בעלות נמוכה המורכבת כמעט כולה מחלקים מסחרייםזמינים 11. גרסת הבסיס של המערכת מאפשרת לשמור תרביות מרובות בלוחית באר בחממת CO2 ולחדור באופן רציף עם מדיום ממשאבת מזרק, בעוד שזרמי המדיום השפכים מהתרביות מחולקים באופן אוטומטי לדגימות לאורך זמן באמצעות אספן שברים עם שינוי מותאם אישית. לפיכך, מערכת זו מאפשרת דגימה אוטומטית של תרבית בינונית סופר-נאטנטית וקלט מומס רציף לתרבויות לאורך זמן. המערכת היא מקרופלואידית ומודולרית וניתנת לשינוי בקלות כדי לענות על הצרכים של תכנוני ניסוי חדשניים.
המטרה הכוללת של השיטה המוצגת כאן היא לבנות, לאפיין ולהשתמש במערכת תרביות תאים פרפוזיה המאפשרת ניסויים שבהם נמדדים שיעורי ההפרשה או הקליטה של חומרים על ידי תאים לאורך זמן, ו/או תאים נחשפים לאותות מומסים מדויקים וחולפים. מאמר וידאו זה מסביר כיצד להרכיב את מערך הבסיס, המסוגל לחדור עד שש תרביות תאים בו זמנית באמצעות משאבת מזרק אחת ואספן שברים שונה. שתי גרסאות שימושיות במערכת הבסיס שעושות שימוש במשאבות ובחלקים נוספים כדי לאפשר ניסויים שחושפים את התאים לאותות ריכוז מומס חולפים, כולל פולסים קצרים ופרופילים דמויי פרמקוקינטיים12, מוצגים גם הם באיור 1.
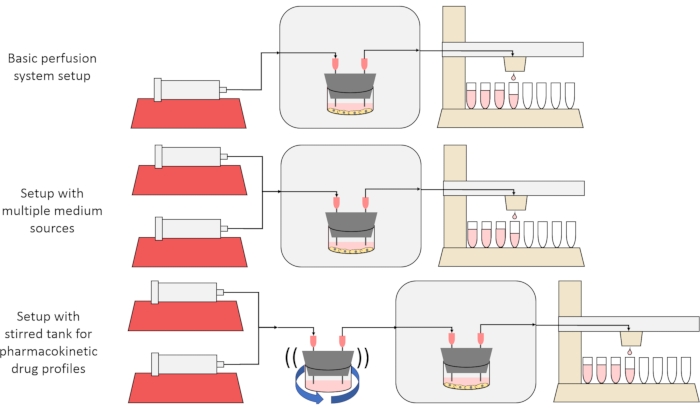
איור 1: שלוש וריאציות על תכנון מערכת הזלוף. (באמצע) מערכת הזלוף עם סטופקוק למספר מקורות בינוניים. (למטה) מערכת הזלוף עם מיכל מעורבב כדי לחקות נפח מעורבב היטב של התפלגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
עקב פיזור ודיפוזיה בתוך הזרימה, אותות המומס מתעוותים או “נמרחים” כשהם נעים במערכת הזרימה. ניתן לכמת עיוות זה באמצעות שימוש בהתפלגויות זמן מגורים (RTDs)13. מאמר זה מסביר כיצד לבצע ניסויי מעקב על רכיבים של מערכת הזלוף (איור 2), ומספק סקריפטים של MATLAB ליצירת RTDs מנתונים שנמדדו. הסבר מפורט לניתוח זה ניתן למצוא במאמרם הקודם של המחברים11. סקריפטים נוספים של MATLAB מתאימים לפונקציות המתאימות ל-RTDs ומחלצים פרמטרים פיזיקליים, ומבצעים קונבולוציה של אותות אות באמצעות RTDs כדי לחזות כיצד קלט אות המומס על ידי המשתמש יפיץ ויעוות דרך מערכת הזלוף14.
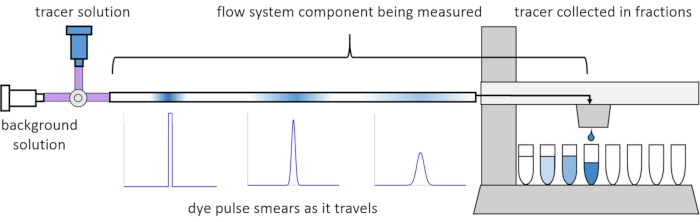
איור 2: התפלגויות זמן מגורים. ה-RTDs של רכיבי מערכת הזרימה, כגון אורך זה של צינורות, נמדדים על ידי הזנת פולס של עוקבים למערכת ומדידת האופן שבו הוא “נמרח” עד שהוא יוצא לשברים שנאספו. נתון זה שונה מ-Erickson et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
עבודה זו מתארת את ההרכבה והתפעול של מערכת תרביות תאים פרפוזיה עם מספר מקורות בינוניים שהוכחו באמצעות דוגמה ספציפית שבה נמדדה הדינמיקה של ביטוי גנים מונעי NF-κB בתגובה לדופק חולף של TNF-α. ה-RTDs של רכיבי מערכת הזלוף נמדדו והודגמו, וקונבולוציית האותות שימשה כדי לחזות הן את חשיפת התאים לפולס TNF-α ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
מחקר זה נערך בתמיכה תחת גרנט מס’. R01EB012521, R01EB028782 ו- T32 GM008339 מהמכונים הלאומיים לבריאות.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

