Multi-Stream-Perfusionsbioreaktor integriert mit Auslassfraktionierung für dynamische Zellkultur
Summary
Dieses Papier stellt eine Methode zum Aufbau und Betrieb eines kostengünstigen, mehrkanaligen Perfusionszellkultursystems zur Messung der Dynamik der Sekretions- und Absorptionsraten von gelösten Stoffen in zellulären Prozessen vor. Das System kann Zellen auch dynamischen Reizprofilen aussetzen.
Abstract
Bestimmte Zell- und Gewebefunktionen arbeiten innerhalb der dynamischen Zeitskala von Minuten bis Stunden, die von herkömmlichen Kultursystemen schlecht aufgelöst werden. Diese Arbeit hat ein kostengünstiges Perfusionsbioreaktorsystem entwickelt, mit dem Kulturmedium kontinuierlich in ein Zellkulturmodul perfundiert und in einem nachgeschalteten Modul fraktioniert werden kann, um die Dynamik auf dieser Skala zu messen. Das System besteht fast ausschließlich aus kommerziell erhältlichen Teilen und kann parallelisiert werden, um unabhängige Experimente in herkömmlichen Multi-Well-Zellkulturplatten gleichzeitig durchzuführen. Dieser Videoartikel zeigt, wie Sie das Basis-Setup zusammenbauen, das nur eine einzige Mehrkanal-Spritzenpumpe und einen modifizierten Fraktionskollektor benötigt, um bis zu sechs Kulturen parallel zu perfusionieren. Es werden auch nützliche Varianten des modularen Aufbaus vorgestellt, die eine kontrollierte Stimulationsdynamik ermöglichen, wie z.B. gelöste Impulse oder pharmakokinetische Profile. Wichtig ist, dass die Signale des gelösten Stoffes, wenn sie durch das System wandern, aufgrund der Dispersion des gelösten Stoffes verzerrt sind. Weiterhin wird ein Verfahren zur Messung der Verweilzeitverteilungen (RTDs) der Komponenten des Perfusionsaufbaus mit einem Tracer unter Verwendung von MATLAB beschrieben. RTDs sind nützlich, um zu berechnen, wie gelöste Signale durch den Durchfluss im Multikompartimentsystem verzerrt werden. Dieses System ist sehr robust und reproduzierbar, so dass Grundlagenforscher es leicht übernehmen können, ohne dass spezielle Fertigungsanlagen erforderlich sind.
Introduction
Viele wichtige biologische Prozesse laufen in Zell- und Gewebekulturen auf der Zeitskala von Minuten bis Stundenab 1,2,3. Während einige dieser Phänomene automatisiert mit Zeitraffermikroskopie4, Biolumineszenz1 oder anderen Methoden beobachtet und aufgezeichnet werden können, werden Experimente mit der Sammlung von Kulturüberstandsproben für die chemische Analyse häufig manuell in statischen Zellkulturen durchgeführt. Die manuelle Probenahme schränkt die Durchführbarkeit bestimmter Studien ein, da häufige oder außerbörsliche Probenahmezeitpunkte unbequem sind. Zu den weiteren Mängeln statischer Kulturmethoden gehören Experimente mit kontrollierten, vorübergehenden Expositionen gegenüber chemischen Reizen. In statischen Kulturen müssen Reize manuell hinzugefügt und entfernt werden, und Reizprofile sind auf Schrittänderungen im Laufe der Zeit beschränkt, während mittlere Änderungen auch andere Mediumskomponenten hinzufügen und entfernen, die Zellen auf unkontrollierte Weise beeinflussen können5. Fluidische Systeme können diese Herausforderungen meistern, aber bestehende Geräte stellen andere Herausforderungen dar. Mikrofluidische Geräte sind mit den unerschwinglichen Kosten für spezielle Ausrüstung und Schulungen zur Herstellung und Verwendung verbunden, erfordern mikroanalytische Methoden zur Verarbeitung von Proben und Zellen sind nach der Perfusion schwer aus den Geräten zu gewinnen6. Nur wenige makrofluidische Systeme wurden für die hier beschriebenen Arten von Experimenten entwickelt 7,8,9,10, und sie bestehen aus mehreren kundenspezifischen Teilen, die im eigenen Haus hergestellt werden und mehrere Pumpen oder Fraktionskollektoren erfordern. Darüber hinaus sind den Autoren keine kommerziell erhältlichen makrofluidischen Perfusionszellkultursysteme außer Rührkesselbioreaktoren für die Suspensionskultur bekannt, die für die Bioproduktion nützlich sind, jedoch nicht für die Modellierung und das Studium der Physiologie ausgelegt sind.
Die Autoren berichteten zuvor über das Design eines kostengünstigen Perfusionsbioreaktorsystems, das fast ausschließlich aus kommerziell erhältlichen Teilen11 besteht. Die Basisversion des Systems ermöglicht es, mehrere Kulturen in einer Bohrlochplatte in einem CO 2-Inkubator zu halten und kontinuierlich mit Medium aus einer Spritzenpumpe zu perfundieren, während die Abwassermittelströme aus den Kulturen im Laufe der Zeit automatisch zu Proben fraktioniert werden, wobei ein Fraktionskollektor mit einer kundenspezifischen Modifikation verwendet wird. Somit ermöglicht dieses System eine automatisierte Probenahme von Kulturmediumüberständen und kontinuierlichen gelösten Stoffen in die Kulturen im Laufe der Zeit. Das System ist makrofluidisch und modular aufgebaut und kann leicht modifiziert werden, um die Anforderungen neuartiger Versuchsdesigns zu erfüllen.
Das übergeordnete Ziel der hier vorgestellten Methode ist es, ein Perfusionszellkultursystem zu konstruieren, zu charakterisieren und zu verwenden, das Experimente ermöglicht, bei denen die Sekretions- oder Absorptionsraten von Substanzen durch Zellen im Laufe der Zeit gemessen werden und/oder Zellen präzisen, transienten gelösten Signalen ausgesetzt werden. Dieser Videoartikel erklärt, wie Sie das Basis-Setup zusammenbauen, das in der Lage ist, bis zu sechs Zellkulturen gleichzeitig mit einer einzigen Spritzenpumpe und einem modifizierten Fraktionssammler zu durchbluten. Zwei nützliche Varianten des Basissystems, die zusätzliche Pumpen und Teile verwenden, um Experimente zu ermöglichen, die Zellen transienten Konzentrationssignalen für gelöste Stoffe aussetzen, einschließlich kurzer Pulse und pharmakokinetischer ähnlicher Profile12, werden ebenfalls vorgestellt, wie in Abbildung 1 dargestellt.
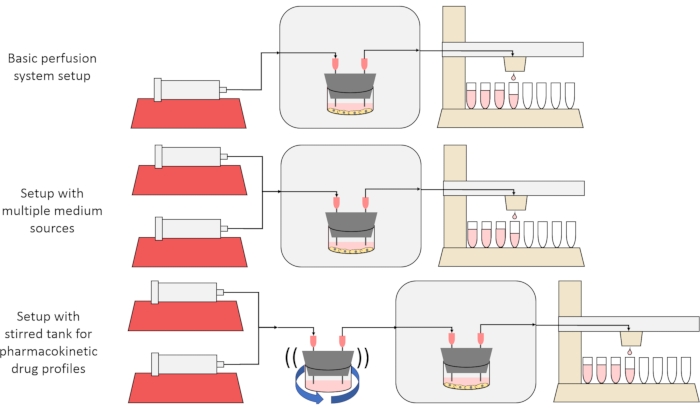
Abbildung 1: Drei Variationen des Perfusionssystemdesigns. (Top) Das grundlegende Perfusionssystem. (Mitte) Das Perfusionssystem mit einem Absperrhahn für mehrere mittlere Quellen. (Unten) Das Perfusionssystem mit einem gerührten Tank, um ein gut gemischtes Verteilungsvolumen nachzuahmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Aufgrund der Dispersion und Diffusion innerhalb der Strömung werden die gelösten Signale verzerrt oder “verschmiert”, wenn sie durch das Strömungssystem wandern. Diese Verzerrung kann durch die Verwendung von Verweilzeitverteilungen (RTDs)13 quantifiziert werden. In diesem Artikel wird erläutert, wie Tracer-Experimente an Komponenten des Perfusionssystems durchgeführt werden (Abbildung 2), und es werden MATLAB-Skripte zum Generieren von RTDs aus Messdaten bereitgestellt. Eine detaillierte Erläuterung dieser Analyse findet sich im vorherigen Paper11 der Autoren. Zusätzliche MATLAB-Skripte passen die entsprechenden Funktionen an die RTDs an, extrahieren physikalische Parameter und führen eine Signalfaltung mithilfe von RTDs durch, um vorherzusagen, wie sich der Benutzer durch das Perfusionssystem ausbreitet und verzerrt14.
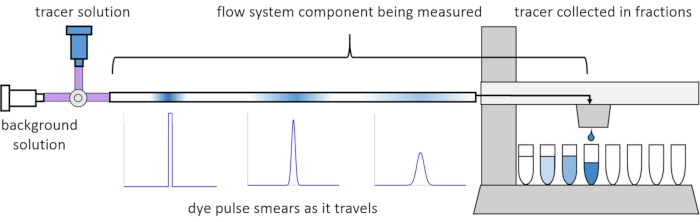
Abbildung 2: Verweilzeitverteilungen. Die RTDs von Strömungssystemkomponenten, wie diese Länge der Röhren, werden gemessen, indem ein Impuls des Tracers in das System eingegeben wird und gemessen wird, wie er “schmiert”, wenn er in die gesammelten Fraktionen austritt. Diese Figur wurde von Erickson et al.11 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Diese Arbeit beschreibt den Aufbau und Betrieb eines Perfusionszellkultursystems mit mehreren Medienquellen, demonstriert mit einem spezifischen Beispiel, in dem die Dynamik der NF-κB-gesteuerten Genexpression als Reaktion auf einen transienten Puls von TNF-α gemessen wurde. Die RTDs der Komponenten des Perfusionssystems wurden gemessen und modelliert, und die Signalfaltung wurde verwendet, um sowohl die Exposition der Zellen gegenüber dem TNF-α-Puls als auch die TNF-α-Verteilung in den gesammelten Abwassermediumfra…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde mit Unterstützung unter Grant Nos durchgeführt. R01EB012521, R01EB028782 und T32 GM008339 von den National Institutes of Health.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

