İskelet Kasında Kas İçi Yağ Oluşumunu ve Hücresel Kökenini İnceleme Kılavuzu
Summary
Sağlıklı kas dokusunun kas içi yağ ile değiştirilmesi, insan hastalıklarının ve koşullarının belirgin bir özelliğidir. Bu protokol, kas içi yağın nasıl görselleştirileceğini, görüntüleneceğini ve ölçüleceğini ana hatlarıyla belirtir ve kas içi yağ oluşumunun altında yatan mekanizmaların titizlikle incelenmesine izin verir.
Abstract
Fibro-adipojenik progenitörler (FAP’ler), iskelet kası homeostazı ve rejenerasyonu sırasında çok önemli bir rol oynayan mezenkimal stromal hücrelerdir. FAP’lar, moleküler miyofiber iskelesi gibi davranan hücre dışı matrisi oluşturur ve korur. Ek olarak, FAP’lar miyofiber rejenerasyonu için vazgeçilmezdir, çünkü kas kök hücreleri (MuSC’ler) tarafından algılanan çok sayıda faydalı faktör salgılarlar. Bununla birlikte, hastalıklı durumlarda, FAP’lar kas içi yağ ve fibrotik skar dokusunun hücresel kökenidir. Bu yağlı fibrozis, sarkopeni ve Duchenne Musküler Distrofi gibi nöromüsküler hastalıkların bir işaretidir. FAP’ların kas içi yağa neden ve nasıl farklılaştığını belirlemede önemli bir engel, özellikle dondurulmuş doku kesitlerinde, adipositlerin etkili bir şekilde korunması ve daha sonra görselleştirilmesidir. Çırpınarak dondurma gibi geleneksel iskelet kası dokusu işleme yöntemleri, bireysel adipositlerin morfolojisini uygun şekilde korumaz, böylece doğru görselleştirme ve nicelleştirmeyi önler. Bu engelin üstesinden gelmek için, iskelet kası bölümlerinde adiposit morfolojisini koruyan, kas içi yağın görselleştirilmesine, görüntülenmesine ve nicelleştirilmesine izin veren titiz bir protokol geliştirilmiştir. Protokol ayrıca, RT-qPCR için kas dokusunun bir kısmının nasıl işleneceğini de özetleyerek, kullanıcıların adipojenik genlerin ekspresyonundaki farklılıkları görüntüleyerek yağ oluşumunda gözlenen değişiklikleri doğrulamalarını sağlar. Ek olarak, kas örneklerinin tamamen monte immünofloresansı ile adipositleri görselleştirmek için uyarlanabilir. Son olarak, bu protokol, FAP’ların adipojenik dönüşümünü incelemek için Pdgfrα eksprese eden FAP’ların genetik soy izlemesinin nasıl yapılacağını özetlemektedir. Bu protokol, RT-qPCR ile doğrulanması ile birlikte, adipositlerin yüksek çözünürlüklü ve morfolojik olarak doğru immünofloresan görüntülerini tutarlı bir şekilde verir ve kas içi yağın sağlam, titiz ve tekrarlanabilir görselleştirmesine ve miktarına izin verir. Birlikte, burada açıklanan analiz boru hattı, FAP’ların kas içi yağa nasıl farklılaştığına dair anlayışımızı geliştirmenin ilk adımıdır ve yağ oluşumunu önlemek için yeni müdahaleleri doğrulamak için bir çerçeve sağlar.
Introduction
Sağlıklı kas dokusunun yağlı fibrozis ile infiltrasyonu, Duchenne Kas Distrofisi (DMD) ve diğer nöromüsküler hastalıkların yanı sıra sarkopeni, obezite ve diyabetin belirgin bir özelliğidir 1,2,3,4,5,6,7,8,9,10 . Bu koşullarda artan yağ infiltrasyonu, azalmış kas fonksiyonu ile güçlü bir şekilde ilişkili olmasına rağmen, kas içi yağ formlarının neden ve nasıl oluştuğuna dair bilgimiz hala sınırlıdır. FAP’lar, iskelet kası11,12 dahil olmak üzere çoğu yetişkin organda bulunan multipotent bir mezenkimal stromal hücre popülasyonudur. Bununla birlikte, yaşla birlikte ve kronik hastalıklarda, FAP’lar fibrotik skar dokusu üretir ve bireysel miyolifler arasında bulunan ve kas içi yağ 13,14,15,16,17,18,19,20 oluşturan adipositlere farklılaşır.
Kas içi yağ oluşumu ile mücadeleye başlamak için, FAP’ların adipositlere nasıl dönüştüğünün mekanizmalarının tanımlanması gerekir. PDGFRα, 13,16,17,18,20,21,22,23,24,25,26,27 numaralı birden fazla türün kasındaki FAP’ları tanımlamak için alandaki “altın standart” belirteçtir. Sonuç olarak, Pdgfrα promotorunun kontrolü altında birkaç murin tamoksifen ile indüklenebilir Cre hattı üretildi ve Cre-LoxP sistemi27,28,29 kullanılarak FAC’ların in vivo olarak genetik olarak manipüle edilmesine izin verildi. Örneğin, bu indüklenebilir Cre çizgisini genetik bir muhabirle birleştirerek, FAP’ların soy takibi yapılabilir, bu strateji kas ve beyaz yağ dokusundaki kader haritası FAP’larına başarıyla uyguladığımız bir strateji20,30. Soy çizgisi izlemenin yanı sıra, bu Cre çizgileri FAP’tan yağa dönüşümü incelemek için değerli araçlar sağlar.
FAP’ların kas içi yağa adipojenik dönüşüm mekanizmasını tanımlamadaki en büyük engellerden biri, farklı koşullar altında oluşan kas içi yağ miktarını titizlikle ve tekrar tekrar ölçme yeteneğidir. Anahtar, kas ve yağ dokusunun korunmasını dengelemek ve bunu adipositleri görselleştirmek için mevcut boyama yöntemleriyle eşleştirmektir. Örneğin, iskelet kası genellikle önceden fiksasyon yapılmadan dondurulur, miyolifleri korur ancak adiposit morfolojisini bozar (Şekil 1). Buna karşılık, fiksasyonun ardından parafin gömülmesi, adipositler de dahil olmak üzere en iyi doku histolojisini sergilerken, tüm lipitleri uzaklaştırır, böylece yaygın olarak kullanılan boya Yağı Kırmızı O gibi çoğu lipofilik boyayı kullanılamaz hale getirir.
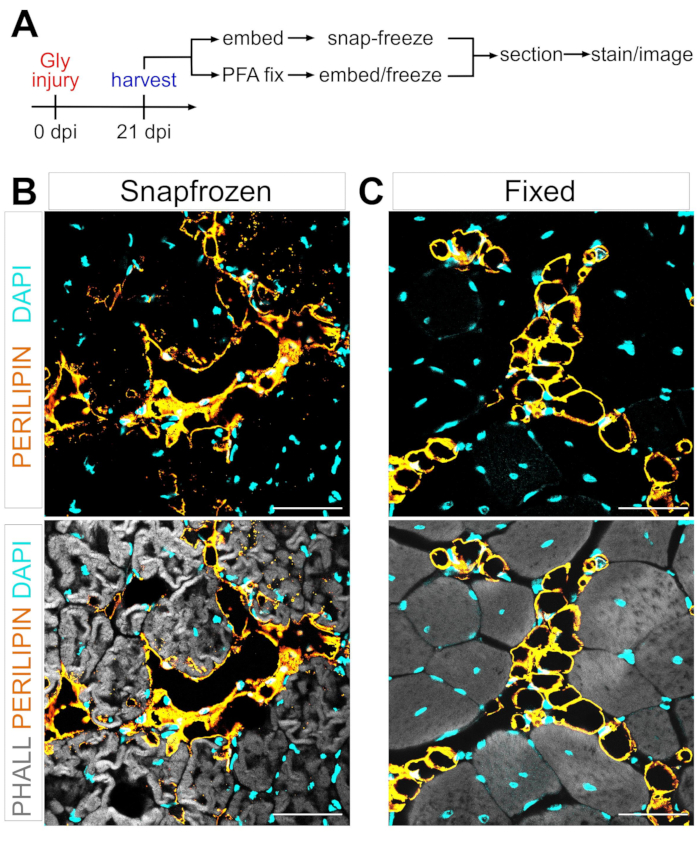
Şekil 1: Anlık dondurulmuş ve sabit kas dokularındaki kas içi yağın temsili görüntüleri . (A) Deney düzeneğine şematik genel bakış. Hem (B) dondurulmuş hem de (C) gliserol hasarından sonraki 21 günde sabit TA’larda adipositleri (sarı), miyolifleri (gri) ve çekirdekleri (camgöbeği) gösteren immünofloresan görüntüler. Ölçek çubukları: 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada açıklanan protokol miyofiber ve adiposit morfolojisini korur ve çoklu hücre tiplerinin görselleştirilmesine ve analizine izin verir. Bu yaklaşım, paraformaldehit (PFA) ile sabitlenmiş kas dokusundaki adipositlerin immünofloresan boyamasına dayanır ve bu da çoklu antikorlarla birlikte boyanmaya izin verir. Ayrıca, tam montajlı görüntüleme kullanılarak sağlam dokudaki kas içi yağın mekansal olarak görüntülenmesi için kolayca uyarlanabilir, böylece kas içindeki yağın hücresel mikro ortamı hakkında bilgi sağlar. Ek olarak, bu protokol, kas sağlığını değerlendirmek için önemli bir ölçüm olan sabit kas dokularındaki miyoliflerin kesit alanını belirlemek için yakın zamanda yayınlanan yaklaşımımızla birleştirilebilir31. Bu yaklaşımı, FAP’ların adipositlere farklılaşmasını kader haritalamak için genetik soy izleme ile birleştirmek de burada özetlenmiştir. Bu nedenle, burada açıklanan çok yönlü protokol, FAP’ların titiz ve tekrarlanabilir bir şekilde değerlendirilmesini ve doku kesitlerinde ve bozulmamış dokularda kas içi yağa farklılaşmasını sağlar.
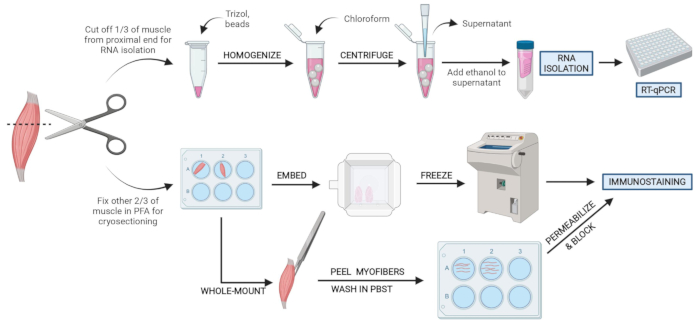
Şekil 2: Şematik protokole genel bakış. TA’nın üçte birinin çıkarıldığı, çırpıda dondurulduğu ve RT-qPCR aracılığıyla sonraki RNA izolasyonu ve transkripsiyon analizi için homojenize edildiği doku işlemeye şematik genel bakış. TA’nın diğer üçte ikisi PFA’ya sabitlenir ve dondurulmuş kesitler veya tam montajlı lifler üzerinde immün boyama için işlenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu protokol, kas içi yağın verimli bir şekilde görselleştirilmesine ve titizlikle ölçülmesine olanak tanıyan kapsamlı ve ayrıntılı bir protokolü özetlemektedir. Aynı kası, biri immünofloresan diğeri RT-qPCR analizi için kullanılan iki parçaya bölerek, bu protokol aynı zamanda çok yönlüdür. Ayrıca, belirli koşullar altında adipositlere dönüşümlerini incelemek için FAP’ların genetik soy takibi ile birleştirilebilir ve çoklu ek hücre tiplerini etiketlemek ve görüntülemek için oldukça uyarlanabilir.
Kas içi yağları görselleştirmek için en sık kullanılan yollar parafin kesitleri, ardından hematoksilin ve eozin boyama veya Oil Red O (ORO) gibi lipofilik boyalar için boyanmış dondurulmuş kesitlerdir. Bununla birlikte, parafin ile işlenmiş dokular en iyi histolojiyi korurken, aynı işlem lipofilik boyaların kullanımını önleyen tüm lipitleri de çıkarır. Lipofilik boyama yöntemleri hem PFA ile sabitlenmiş hem de sabitlenmemiş doku kesitlerinde işe yarayacak olsa da, lipit damlacıkları kapak kaymasına basınç uygulanarak kolayca yer değiştirir, böylece kas içi yağın uzamsal dağılımını bozar. Bunu atlatmak için, yakın tarihli bir çalışma, ORO + adipositleri bütüne monte bir yaklaşım kullanarak görselleştirmek için titiz bir protokol oluşturdu. Bunun için yazarlar, kas içi yağın tüm TA41 boyunca uzamsal dağılımını görselleştirmek için TA’yı hücreselleştirdiler. Bu teknik ne kadar güçlü olursa olsun, ek hücresel yapıları işaretlemek için diğer ko-lekelerin kullanılmasını da önler. Burada sunulan tüm montaj immünofloresan yaklaşımı, hücresel ortamın ince haritalanmasına izin veren çeşitli belirteçlerle adipositleri birlikte boyamak için kullanılabilir. Bununla birlikte, en büyük zorluklardan biri, antikorların doku penetrasyonudur. Ne kadar çok lif bir arada tutulursa, antikorların mevcut tüm antijenlere eşit şekilde nüfuz etmesi ve bağlanması o kadar zor olacaktır. Bu nedenle, bu yöntem küçük lif gruplarına bakarken en etkilidir. Aynı zamanda, kas içi yağın genel anatomik yeri, sadece küçük, soyulmuş lif demetlerine odaklanırken kaybedildiğinden bu da bir sınırlamadır. Bununla birlikte, yeni doku temizleme yöntemlerinin ve yeni görüntüleme teknolojisinin mevcut gelişimi ile birlikte, gelecekte daha fazla doku penetrasyonu ve görselleştirme mümkün olacaktır42,43,44.
Kas dokusunun önceden sabitlenmesi adiposit morfolojisini korurken, kas sağlığının önemli bir ölçümü olan miyoliflerin boyutunu değerlendirmek için de bir zorluk yaratır. Miyofiber boyutu, miyoliflerin kesit alanının ölçülmesiyle belirlenir. Kas dokusunun önceden fiksasyonunun, miyolifleri özetlemek için mevcut belirteçlerin çoğunun31’in başarısız olmasına neden olacağını daha önce bildirmiştik. Bu engelin üstesinden gelmek için, sabit kas bölümleri31’de bile miyofiber boyutunun ölçülmesine izin veren yeni bir görüntü segmentasyon boru hattı geliştirdik. Bu nedenle, bu protokolle birlikte, kas dokusunun önceden sabitlenmesinden kaynaklanan çoğu dezavantajın üstesinden gelen sağlam ve verimli bir doku işleme boru hattı kurduk.
Bu yaklaşımın bir diğer önemli avantajı çok yönlülüktür. TA’yı iki parçaya bölerek, bir kastan elde edilebilecek bilgi miktarı en üst düzeye çıkarılır. Bu sadece hayvan sayısını azaltmakla kalmaz, aynı zamanda gen ekspresyonu yoluyla histolojiyi doğrulayarak ekstra bir kontrol katmanı ekler ve bunun tersi de geçerlidir. Ek olarak, adipojenik genlerin ötesinde birçok farklı gen incelenebilir. İzole RNA, bütün bir kas RNAseq deneyi için de kullanılabilir. Son olarak, dondurulmuş kas parçası protein çalışması için de kullanılabilir. Bu protokolün bir sınırlaması, yaralanmanın TA’nın tüm uzunluğu boyunca tutarlı olmama olasılığıdır. Bu, iki kas parçasının içerdikleri kas içi yağ miktarında farklılaştığı bir senaryoya yol açabilir ve böyle bir numunenin herhangi bir aşağı akış analizinden dışlanmasını garanti edebilir. Bu nedenle, kas içi yağ miktarı hakkında önemli sonuçlar çıkarmak için sadece RT-qPCR’ye güvenilmemesi, bunun yerine histolojik nicelemelere destekleyici veriler olarak güvenilmesi önerilir.
Birlikte, bu protokol, yağlı fibrozla mücadele etmek için yeni tedavi seçeneklerinin geliştirilmesinde ilk adım olan kas içi yağın görselleştirilmesine ve miktarının belirlenmesine izin verecek sağlam, verimli ve titiz bir doku işleme boru hattını özetlemektedir. Aynı zamanda, çok yönlüdür ve kas içindeki birçok farklı hücre tipine ve diğer dokulardaki adipositlere uyarlanabilir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Kopinke laboratuvarı üyelerine, veri toplama ve makalenin eleştirel okuması konusunda yardımcı oldukları için teşekkür ederiz. Ayrıca, Florida Üniversitesi’ndeki Miyoloji Enstitüsü üyelerine, el yazması hakkındaki değerli katkıları için teşekkür ederiz. Çalışma, NIH hibesi 1R01AR079449 tarafından desteklenmiştir. Şekil 2, Biorender ile oluşturulmuştur.
Materials
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides – Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
References
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).

