Construction de réseaux métaboliques hors équilibre dans des vésicules de taille nanométrique et micrométrique
Summary
Nous présentons un protocole pour reconstituer les protéines membranaires et encapsuler des enzymes et d’autres composants solubles dans l’eau dans des vésicules lipidiques de taille submicrométrique et micrométrique.
Abstract
Nous présentons une méthode pour incorporer dans les vésicules des réseaux de protéines complexes, impliquant des protéines membranaires intégrales, des enzymes et des capteurs basés sur la fluorescence, en utilisant des composants purifiés. Cette méthode est pertinente pour la conception et la construction de bioréacteurs et l’étude de réseaux de réactions métaboliques complexes hors équilibre. Nous commençons par reconstituer des protéines membranaires (multiples) en grandes vésicules unilamellaires (LUV) selon un protocole préalablement développé. Nous encapsulons ensuite un mélange d’enzymes purifiées, de métabolites et de capteurs basés sur la fluorescence (protéines fluorescentes ou colorants) par congélation-décongélation-extrusion et éliminons les composants non incorporés par centrifugation et/ou chromatographie d’exclusion stérique. La performance des réseaux métaboliques est mesurée en temps réel en surveillant le rapport ATP/ADP, la concentration en métabolites, le pH interne ou d’autres paramètres par lecture de fluorescence. Nos vésicules contenant des protéines membranaires de 100 à 400 nm de diamètre peuvent être converties en vésicules unilamellaires géantes (GUV), en utilisant des procédures existantes mais optimisées. L’approche permet d’inclure des composants solubles (enzymes, métabolites, capteurs) dans des vésicules de taille micrométrique, augmentant ainsi le volume des bioréacteurs de plusieurs ordres de grandeur. Le réseau métabolique contenant les GUVs est piégé dans des dispositifs microfluidiques pour être analysé par microscopie optique.
Introduction
Le domaine de la biologie synthétique ascendante se concentre sur la construction de cellules (minimales) 1,2 et de bioréacteurs métaboliques à des fins biotechnologiques 3,4 ou biomédicales 5,6,7,8. La construction de cellules synthétiques fournit une plate-forme unique qui permet aux chercheurs d’étudier les protéines (membranaires) dans des conditions bien définies imitant celles des environnements natifs, permettant la découverte de propriétés émergentes et de fonctions biochimiques cachées des protéines et des réseaux de réactions9. En tant qu’étape intermédiaire vers une cellule synthétique fonctionnant de manière autonome, des modules sont développés qui capturent les caractéristiques essentielles des cellules vivantes telles que la conservation de l’énergie métabolique, la synthèse des protéines et des lipides et l’homéostasie. De tels modules améliorent non seulement notre compréhension de la vie, mais ont également des applications potentielles dans les domaines de la médecine8 et de la biotechnologie10.
Les protéines transmembranaires sont au cœur de pratiquement tous les réseaux métaboliques, car elles transportent des molécules à l’intérieur ou à l’extérieur de la cellule, signalent et répondent à la qualité de l’environnement et jouent de nombreux rôles biosynthétiques. Ainsi, l’ingénierie de modules métaboliques dans des cellules synthétiques nécessite dans la plupart des cas la reconstitution de protéines membranaires intégrales et/ou périphériques en une bicouche membranaire composée de lipides spécifiques et d’une grande intégrité (faible perméabilité). La manipulation de ces protéines membranaires est un défi et nécessite des connaissances spécifiques et des compétences expérimentales.
Plusieurs méthodes ont été développées pour reconstituer des protéines membranaires au sein des vésicules phospholipidiques, le plus souvent dans le but d’étudier la fonction11,12, la régulation13, les propriétés cinétiques14,15, la dépendance lipidique15,16 et/ou la stabilité17 d’une protéine spécifique. Ces méthodes impliquent la dilution rapide des protéines solubilisées au détergent dans un milieu aqueux en présence de lipides18, l’élimination des détergents par incubation de protéines solubilisées au détergent avec des vésicules lipidiques déstabilisées par le détergent et l’absorption du ou des détergents sur des billes de polystyrène19, ou l’élimination des détergents par dialyse ou chromatographie d’exclusion stérique20. Des solvants organiques ont été utilisés pour former des vésicules lipidiques, par exemple, via la formation d’interphases huile-eau21, mais la majorité des protéines membranaires intégrales sont inactivées lorsqu’elles sont exposées à de tels solvants.
Dans notre laboratoire, nous reconstituons principalement les protéines membranaires par la méthode d’absorption détergente pour former de grandes vésicules unilamellaires (LUVs)19. Cette méthode permet la co-reconstitution de plusieurs protéines membranaires et l’encapsulation dans la lumière vésiculaire d’enzymes, de métabolites et de sondes22,23. Les LUV contenant des protéines membranaires peuvent être convertis en vésicules unilamellaires géantes (GUV) avec/sans encapsulation de composants solubles dans l’eau, en utilisant soit l’électroformation24, soit le gonflement assisté par gel25 et des conditions spécifiques pour préserver l’intégrité des protéines membranaires26.
Cet article présente un protocole pour la reconstitution dans les LUV d’un réseau métabolique hors équilibre qui régénère l’ATP par la décomposition de la L-arginine en L-ornithine27. La formation d’ATP est couplée à la production de glycérol-3-phosphate (G3P), un élément constitutif important pour la synthèse des phospholipides22,28. La voie métabolique se compose de deux protéines membranaires intégrales, une arginine/ornithine (ArcD) et un antiporteur G3P/Pi (GlpT). De plus, trois enzymes solubles (ArcA, ArcB, ArcC) sont nécessaires au recyclage de l’ATP, et GlpK est utilisé pour convertir le glycérol en glycérol 3-phosphate, en utilisant l’ATP issu de la dégradation de la L-arginine, voir la figure 1 pour une vue d’ensemble schématique de la voie. Ce protocole représente un bon point de départ pour la construction future de réseaux réactionnels encore plus complexes, pour la synthèse de lipides ou de protéines ou la division des cellules. La composition lipidique des vésicules soutient l’activité d’une grande variété de protéines membranaires intégrales et a été optimisée pour le transport de diverses molécules dans ou hors des vésicules 27,29,30.
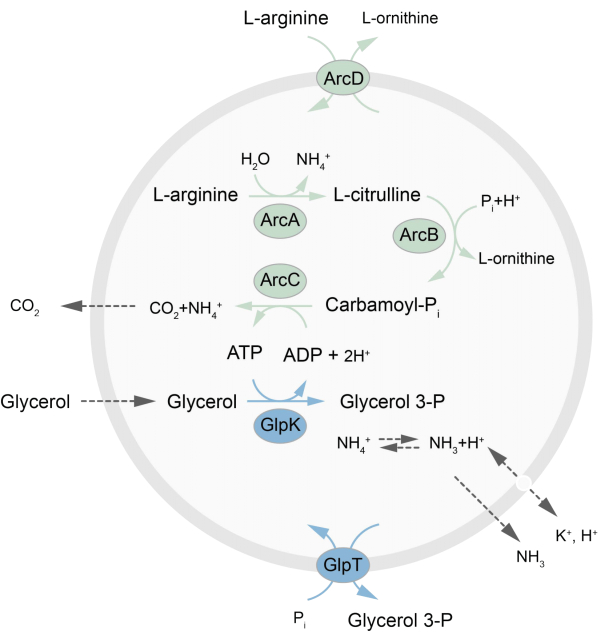
Figure 1 : Vue d’ensemble de la voie de production de l’ATP et de la synthèse et de l’excrétion du glycérol 3-phosphate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
En bref, des protéines membranaires purifiées (solubilisées dans du dodécyl-β-D-maltoside, DDM) sont ajoutées à des vésicules lipidiques préformées qui ont été déstabilisées avec Triton X-100, ce qui permet l’insertion des protéines dans la membrane. Les molécules de détergent sont ensuite (lentement) éliminées par l’ajout de billes de polystyrène activées, ce qui entraîne la formation de protéoliposomes bien scellés. Des composants solubles peuvent ensuite être ajoutés aux vésicules et encapsulés via des cycles de gel-dégel, ce qui piège les molécules dans le processus de fusion membranaire. Les vésicules obtenues sont très hétérogènes et beaucoup sont multilamellaires. Ils sont ensuite extrudés à travers un filtre en polycarbonate avec une taille de pores de 400, 200 ou 100 nm, ce qui donne des vésicules de taille plus uniforme ; Plus la taille des pores est petite, plus les vésicules sont homogènes et unilamellaires, mais au prix d’un volume interne plus petit. Les protéines non incorporées et les petites molécules sont éliminées de la solution externe par chromatographie d’exclusion stérique. Les proteoLUV peuvent être convertis en vésicules de taille micrométrique par gonflement assisté par gel, et ces proteoGUVs sont ensuite collectés et piégés dans une puce microfluidique pour la caractérisation et la manipulation microscopiques. La figure 2 présente une vue d’ensemble schématique de l’ensemble du protocole.
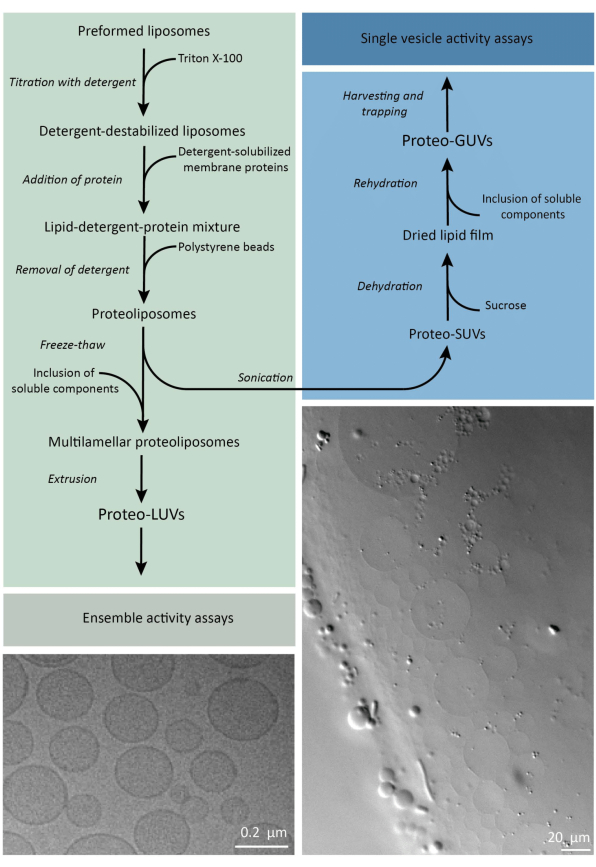
Figure 2 : Vue d’ensemble du protocole de reconstitution des protéines membranaires et d’encapsulation d’enzymes et de composants hydrosolubles dans des vésicules lipidiques submicrométriques (LUV) et micrométriques (GUV). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les protocoles de reconstitution et d’encapsulation fonctionnent bien et la fonctionnalité des protéines est conservée, mais les proteoLUVs et les proteoGUVs sont de taille hétérogène. Les approches microfluidiques31,32 permettent la formation de vésicules de taille micrométrique de taille plus homogène, mais la reconstitution fonctionnelle des protéines membranaires n’est généralement pas possible car le solvant résiduel dans la bicouche inactive les protéines. La taille des protéoLUV varie de 100 à 400 nm, et à de faibles concentrations d’enzymes, l’encapsulation peut conduire à des vésicules avec des voies métaboliques incomplètes (effets stochastiques ; voir Figure 3). Les LUV sont idéaux pour construire des modules métaboliques spécifiques, comme le montre ici la production d’ATP et de blocs de construction comme le G3P. De tels protéoLUV peuvent potentiellement être encapsulés dans des GUV et servir de compartiments semblables à des organites pour les vésicules hôtes.
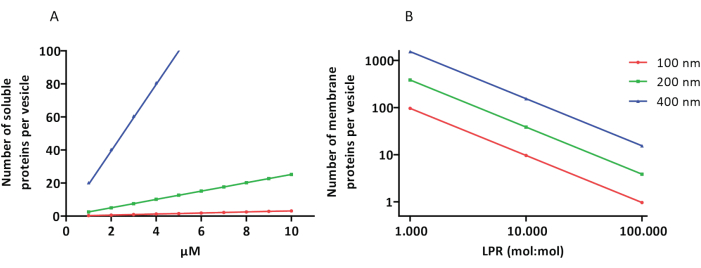
Figure 3 : Nombre de molécules par vésicule d’un diamètre de 100, 200 ou 400 nm. (A) Lorsque les protéines encapsulées (enzymes, sondes) sont dans la gamme de 1 à 10 μM. (B) La reconstitution se fait à 1 à 1 000, 1 à 10 000 et 1 à 100 000 protéines membranaires par lipide (mol/mol). Nous faisons l’hypothèse que les molécules sont encapsulées aux concentrations indiquées et incorporées dans la membrane à ces ratios protéines/lipides. Pour certaines enzymes, nous avons vu qu’elles se lient aux membranes, ce qui peut augmenter leur concentration apparente dans les vésicules. Abréviation : LPR = Lipid-Protein-Ratio Veuillez cliquer ici pour voir une version agrandie de ce chiffre.
Protocol
Representative Results
Discussion
Nous présentons un protocole pour la synthèse de protéines (membranaires) contenant des vésicules lipidiques de taille submicrométrique (proteoLUVs), et la conversion de proteoLUVs en vésicules géantes-unilamellaires (proteoGUVs). Le protocole devrait être applicable à la reconstitution d’autres protéines membranaires 13,19,30,40 et à l’encapsulation de réseaux métaboliques autres que les voies de dégradation de la L-arginine et de synthèse du glycérol 3-phosphate présentées …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient Aditya Iyer pour le clonage du gène pBAD-PercevalHR et Gea Schuurman-Wolters pour son aide à la production et à la purification des protéines. La recherche a été financée par le programme de gravitation du NWO « Building a Synthetic Cell » (BaSyC).
Materials
| Agarose | Sigma Aldrich | A9414-25g | |
| Amicon cut-off filter | Sigma Aldrich | Milipore centrifugal filter units Amicon Ultra | |
| BioBeads | BioRad | 152-3920 | |
| CHCl3 | Macron Fine Chemicals | MFCD00000826 | |
| D(+)-Glucose | Formedium | – | |
| D(+)-Sucrose | Formedium | – | |
| DDM | Glycon | D97002 -C | |
| Diethyl Ether | Biosolve | 52805 | |
| DMSO | Sigma-Aldrich | 276855-100ml | |
| DOPC | Avanti | 850375P-1g | |
| DOPE | Avanti | 850725P-1g | |
| DOPG | Avanti | 840475P-1g | |
| DTT | Formedium | DTT005 | |
| EtOH | J.T.Baker Avantor | MFCD00003568 | |
| Extruder | Avestin Inc | LF-1 | |
| Fluorimeter | Jasco | Spectrofluorometer FP-8300 | |
| Glycerol | BOOM | 51171608 | |
| Gravity flow column | Bio-Rad | 732-1010 | |
| Hamilton syringe 100 µL | Hamilton | 7656-01 | |
| Hamilton syringe 1000 µL | Hamilton | 81320 | |
| Handheld LCP dispenser | Art Robbins Instruments | 620-411-00 | |
| Handheld Sonicator | Hielscher Ultrasound Technology | UP50H | |
| HCl | BOOM | x76021889.1000 | |
| Imidazole | Roth | X998.4-250g | |
| K2HPO4 | Supelco | 1.05099.1000 | |
| KCl | BOOM | 76028270.1 | |
| KH2PO4 | Supelco | 1.04873.1000 | |
| Kimwipe | Kimtech Science | 7552 | |
| Large Falcon tube centrifuge | Eppendorf | Centrifuge 5810 R | |
| L-Arginine | Sigma-Aldrich | A5006-100G | |
| Light microscope | Leica | DM LS2 | |
| L-Ornithine | Roth | T204.1 | |
| LSM Laser Scanning Confocal Microscope | Zeiss | LSM 710 ConfoCor 3 | |
| MgCl2 | Sigma-Aldrich | M2670-1KG | |
| Microfluidic chip | Homemade | PDMS based | DOI: https://doi.org/10.1039/C8LC01275J |
| Na-ADP | Sigma-Aldrich | A2754-1G | |
| NaCl | Supelco | 1.06404.1000 | |
| Nanodrop Spectrometer | Isogen Life Science | ND-1000 spectrophotometer NanoDrop | |
| NaOH | Supelco | 1.06498.1000 | |
| Needles for GUVs | Henke-Ject | 14-14575 | 27 G x 3/4'' 0.4 x 20 mm |
| Needles for microfluidics | Henke-Ject | 14-15538 | 18 G x 1 1/2'' 1.2 x 40 mm |
| Ni2+ Sepharose | Cytiva | 17526802 | |
| Nigericin | Sigma-Aldrich | N7143-5MG | |
| Nutator | VWR | 83007-210 | |
| Osmolality meter | Gonotec Salmenkipp | Osmomat 3000 basic freezing point osmometer | |
| Plasmacleaner | Plasma Etch | PE-Avenger | |
| Polycarbonate filter | Cytiva Whatman | Nuclepor Track-Etch Membrane Product: 10417104 | 0.4 µm |
| Polycarbonate ultracentrifuge tube | Beckman Coulter | 355647 | |
| Pyranine | Acros Organics | H1529-1G | |
| Quartz cuvette (black) | Hellma Analytics | 108B-10-40 | |
| Sephadex G-75 resin | GE Healthcare | 17-0050-01 | |
| Sonicator | Sonics Sonics & Materials INC | Sonics vibra cell | |
| Syringe filter | Sarstedt | Filtropur S plus 0.2 | 0.2 µm |
| Syringe pump | Harvard Apparatus | A-42467 | |
| Tabletop centrifuge | Eppendorf | centrifuge 5418 | |
| Teflon spacer | Homemade | Teflon based | 45 x 26 x 1.5 or 45 x 26 x 3 or 20 x 20 x 3 mm |
| Tris | PanReac AppliChem | A1086.1000 | |
| Triton X-100 | Sigma Aldrich | T8787-100 ml | |
| Ultracentrifuge | Beckman Coulter | Optima Max-E | |
| UV lamp | Spectroline | ENB-280C/FE | |
| UV/VIS Spectrometer | Jasco | V730 spectrophotometer | |
| Valinomycin | Sigma-Aldrich | V0627-10MG | |
| Widefield fluorescence microscope | Zeiss | AxioObserver | |
| β-Casein | Sigma Aldrich | C5890-500g |
References
- Hirschi, S., Ward, T. R., Meier, W. P., Müller, D. J., Fotiadis, D. Synthetic biology: bottom-up assembly of molecular systems. Chem Rev. 122 (21), 16294-16328 (2022).
- Ivanov, I., et al. Bottom-up synthesis of artificial cells: recent highlights and future challenges. Annu Rev Chem Biomol. Eng. 12 (1), 287-308 (2021).
- Clomburg, J. M., Crumbley, A. M., Gonzalez, R. Industrial biomanufacturing: The future of chemical production. Science. 355 (6320), (2017).
- Shi, T., Han, P., You, C., Zhang, Y. -. H. P. J. An in vitro synthetic biology platform for emerging industrial biomanufacturing: Bottom-up pathway design. Synth Syst Biotechnol. 3 (3), 186-195 (2018).
- Wang, A., et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater. 30 (13), 1910168 (2020).
- Kanter, G., et al. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood. 109 (8), 3393-3399 (2007).
- Zeltins, A. Construction and characterization of virus-like particles: a review. Mol Biotechnol. 53 (1), 92-107 (2013).
- Jain, K. K. Synthetic biology and personalized medicine. Med Princ Pract. 22 (3), 209-219 (2013).
- Schwille, P., Frohn, B. P. Hidden protein functions and what they may teach us. Trends Cell Biol. 32 (2), 102-109 (2022).
- Sachsenmeier, P. Industry 5.0-The relevance and implications of bionics and synthetic biology. Engineering. 2 (2), 225-229 (2016).
- Schmidt, D., Jiang, Q. -. X., MacKinnon, R. Phospholipids and the origin of cationic gating charges in voltage sensors. Nature. 444 (7120), 775-779 (2006).
- Godoy-Hernandez, A., et al. Rapid and highly stable membrane reconstitution by LAiR enables the study of physiological integral membrane protein functions. ACS Cent Sci. 9 (3), 494-507 (2023).
- Sikkema, H. R., et al. Gating by ionic strength and safety check by cyclic-di-AMP in the ABC transporter OpuA. Sci Adv. 6 (47), 7697 (2020).
- Foucaud, C., Poolman, B. Lactose transport system of Streptococcus thermophilus. Functional reconstitution of the protein and characterization of the kinetic mechanism of transport. J Biol Chem. 267 (31), 22087-22094 (1992).
- Yoneda, J. S., Sebinelli, H. G., Itri, R., Ciancaglini, P. Overview on solubilization and lipid reconstitution of Na,K-ATPase: enzyme kinetic and biophysical characterization. Biophys Rev. 12 (1), 49-64 (2020).
- Simidjiev, I., et al. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci. 97 (4), 1473-1476 (2000).
- Harris, N. J., Booth, P. J. Folding and stability of membrane transport proteins in vitro. Biochim Biophys Acta BBA – Biomembr. 1818 (4), 1055-1066 (2012).
- Jackson, M. L., Litman, B. J. Rhodopsin-egg phosphatidylcholine reconstitution by an octyl glucoside dilution procedure. Biochim Biophys Acta BBA – Biomembr. 812 (2), 369-376 (1985).
- Geertsma, E. R., Nik Mahmood, N. A. B., Schuurman-Wolters, G. K., Poolman, B. Membrane reconstitution of ABC transporters and assays of translocator function. Nat Protoc. 3 (2), 256-266 (2008).
- Rigaud, J. -. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochim Biophys Acta BBA – Bioenerg. 1231 (3), 223-246 (1995).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc Natl Acad Sci. 75 (9), 4194-4198 (1978).
- . Synthetic Organelles for Energy Conservation and Delivery of Building Blocks for Lipid Biosynthesis Available from: https://www.researchsquare.com/article/rs-3385355/v1 (2023)
- Lee, K. Y., et al. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nat Biotechnol. 36 (6), 530-535 (2018).
- Méléard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation. Methods in Enzymology. , 161-176 (2009).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J. Vis. Exp. (95), e52281 (2015).
- Doeven, M. K., et al. lateral mobility and function of membrane proteins incorporated into giant unilamellar vesicles. Biophys J. 88 (2), 1134-1142 (2005).
- Pols, T., et al. A synthetic metabolic network for physicochemical homeostasis. Nat Commun. 10 (1), 4239 (2019).
- Bailoni, E., Poolman, B. ATP recycling fuels sustainable glycerol 3-phosphate formation in synthetic cells fed by dynamic dialysis. ACS Synth Biol. 11 (7), 2348-2360 (2022).
- Van Der Heide, T. On the osmotic signal and osmosensing mechanism of an ABC transport system for glycine betaine. EMBO J. 20 (24), 7022-7032 (2001).
- Van’T Klooster, J. S., et al. Membrane lipid requirements of the lysine transporter Lyp1 from Saccharomyces cerevisiae. J Mol Biol. 432 (14), 4023-4031 (2020).
- Lou, G., Anderluzzi, G., Woods, S., Roberts, C. W., Perrie, Y. A novel microfluidic-based approach to formulate size-tuneable large unilamellar cationic liposomes: Formulation, cellular uptake and biodistribution investigations. Eur J Pharm Biopharm. 143, 51-60 (2019).
- Weiss, M., et al. Sequential bottom-up assembly of mechanically stabilized synthetic cells by microfluidics. Nat Mater. 17 (1), 89-96 (2018).
- Pols, T., Singh, S., Deelman-Driessen, C., Gaastra, B. F., Poolman, B. Enzymology of the pathway for ATP production by arginine breakdown. FEBS J. 288 (1), 293-309 (2021).
- Yandrapalli, N., Robinson, T. Ultra-high capacity microfluidic trapping of giant vesicles for high-throughput membrane studies. Lab Chip. 19 (4), 626-633 (2019).
- Elias, M., et al. Microfluidic characterization of biomimetic membrane mechanics with an on-chip micropipette. Micro Nano Eng. 8, 100064 (2020).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 044105 (2013).
- Cooper, A., Girish, V., Subramaniam, A. B. Osmotic Pressure Enables High-Yield Assembly of Giant Vesicles in Solutions of Physiological Ionic Strengths. Langmuir. 39 (15), 5579-5590 (2023).
- Tantama, M., Martínez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4 (1), 2550 (2013).
- Setyawati, I., et al. In vitro reconstitution of dynamically interacting integral membrane subunits of energy-coupling factor transporters. eLife. 9, e64389 (2020).
- Oropeza-Guzman, E., Ríos-Ramírez, M., Ruiz-Suárez, J. C. Leveraging the coffee ring effect for a defect-free electroformation of giant unilamellar vesicles. Langmuir. 35 (50), 16528-16535 (2019).
- Estes, D. J., Mayer, M. Electroformation of giant liposomes from spin-coated films of lipids. Colloids Surf B Biointerfaces. 42 (2), 115-123 (2005).

