Costruzione di reti metaboliche fuori equilibrio in vescicole di dimensioni nanometriche e micrometriche
Summary
Presentiamo un protocollo per la ricostituzione delle proteine di membrana e l’incapsulamento di enzimi e altri componenti idrosolubili in vescicole lipidiche di dimensioni sub-micrometriche e micrometriche.
Abstract
Presentiamo un metodo per incorporare nelle vescicole reti proteiche complesse, che coinvolgono proteine di membrana integrali, enzimi e sensori basati sulla fluorescenza, utilizzando componenti purificati. Questo metodo è rilevante per la progettazione e la costruzione di bioreattori e lo studio di complesse reti di reazioni metaboliche fuori equilibrio. Iniziamo ricostituendo (multiple) proteine di membrana in grandi vescicole unilamellari (LUV) secondo un protocollo precedentemente sviluppato. Quindi incapsulamo una miscela di enzimi purificati, metaboliti e sensori basati sulla fluorescenza (proteine fluorescenti o coloranti) tramite liofilizzazione-scongelamento-estrusione e rimuoviamo i componenti non incorporati mediante centrifugazione e/o cromatografia ad esclusione dimensionale. Le prestazioni delle reti metaboliche vengono misurate in tempo reale monitorando il rapporto ATP/ADP, la concentrazione di metaboliti, il pH interno o altri parametri mediante lettura a fluorescenza. Le nostre vescicole contenenti proteine di membrana con diametro di 100-400 nm possono essere convertite in vescicole unilamellari giganti (GUV), utilizzando le procedure esistenti ma ottimizzate. L’approccio consente l’inclusione di componenti solubili (enzimi, metaboliti, sensori) in vescicole di dimensioni micrometriche, aumentando così il volume dei bioreattori di ordini di grandezza. La rete metabolica contenente i GUV è intrappolata in dispositivi microfluidici per l’analisi mediante microscopia ottica.
Introduction
Il campo della biologia sintetica bottom-up si concentra sulla costruzione di cellule (minime) 1,2 e bioreattori metabolici per scopi biotecnologici 3,4 o biomedici 5,6,7,8. La costruzione di cellule sintetiche fornisce una piattaforma unica che consente ai ricercatori di studiare le proteine (di membrana) in condizioni ben definite che imitano quelle degli ambienti nativi, consentendo la scoperta di proprietà emergenti e funzioni biochimiche nascoste delle proteine e delle reti di reazione9. Come passo intermedio verso una cellula sintetica funzionante in modo autonomo, vengono sviluppati moduli che catturano le caratteristiche essenziali delle cellule viventi come la conservazione dell’energia metabolica, la sintesi di proteine e lipidi e l’omeostasi. Tali moduli non solo migliorano la nostra comprensione della vita, ma hanno anche potenziali applicazioni nei campi della medicina8 e della biotecnologia10.
Le proteine transmembrana sono al centro di praticamente qualsiasi rete metabolica in quanto trasportano molecole dentro o fuori dalla cellula, segnalano e rispondono alla qualità dell’ambiente e svolgono numerosi ruoli biosintetici. Pertanto, l’ingegnerizzazione di moduli metabolici in cellule sintetiche richiede nella maggior parte dei casi la ricostituzione di proteine di membrana integrali e/o periferiche in un doppio strato di membrana composto da lipidi specifici e ad alta integrità (bassa permeabilità). La gestione di queste proteine di membrana è impegnativa e richiede conoscenze specifiche e capacità sperimentali.
Sono stati sviluppati diversi metodi per ricostituire le proteine di membrana all’interno delle vescicole fosfolipidiche, il più delle volte con lo scopo di studiare la funzione11,12, la regolazione13, le proprietà cinetiche14,15, la dipendenza dai lipidi15,16 e/o la stabilità17 di una specifica proteina. Questi metodi comportano la rapida diluizione delle proteine solubilizzate con detergente in mezzi acquosi in presenza di lipidi18, la rimozione dei detergenti mediante incubazione di proteine solubilizzate con detergente con vescicole lipidiche destabilizzate con detergente e l’assorbimento del detergente o dei detergenti su perle di polistirene19, o la rimozione dei detergenti mediante dialisi o cromatografia ad esclusione dimensionale20. I solventi organici sono stati utilizzati per formare vescicole lipidiche, ad esempio, attraverso la formazione di interfasi olio-acqua21, ma la maggior parte delle proteine integrali di membrana sono inattivate quando esposte a tali solventi.
Nel nostro laboratorio, ricostituiamo per lo più le proteine di membrana con il metodo dell’assorbimento dei detergenti per formare grandi vescicole unilamellari (LUV)19. Questo metodo consente la co-ricostituzione di più proteine di membrana e l’incapsulamento nel lume della vescicola di enzimi, metaboliti e sonde22,23. I LUV contenenti proteine di membrana possono essere convertiti in vescicole unilamellari giganti (GUV) con/senza incapsulamento di componenti idrosolubili, utilizzando l’elettroformazione24 o il rigonfiamento assistito da gel25 e condizioni specifiche per preservare l’integrità delle proteine di membrana26.
Questo articolo presenta un protocollo per la ricostituzione nei LUV di una rete metabolica fuori equilibrio che rigenera l’ATP attraverso la scomposizione della L-arginina in L-ornitina27. La formazione di ATP è accoppiata alla produzione di glicerolo-3-fosfato (G3P), un importante elemento costitutivo per la sintesi dei fosfolipidi22,28. La via metabolica è costituita da due proteine integrali di membrana, un’arginina/ornitina (ArcD) e un antiporter G3P/Pi (GlpT). Inoltre, sono necessari tre enzimi solubili (ArcA, ArcB, ArcC) per il riciclaggio dell’ATP e il GlpK viene utilizzato per convertire il glicerolo in glicerolo-3-fosfato, utilizzando l’ATP dalla scomposizione della L-arginina, vedere la Figura 1 per una panoramica schematica del percorso. Questo protocollo rappresenta un buon punto di partenza per la futura costruzione di reti di reazione ancora più complesse, per la sintesi di lipidi o proteine o per la divisione delle cellule. La composizione lipidica delle vescicole supporta l’attività di un’ampia varietà di proteine integrali di membrana ed è stata ottimizzata per il trasporto di diverse molecole dentro o fuori le vescicole 27,29,30.
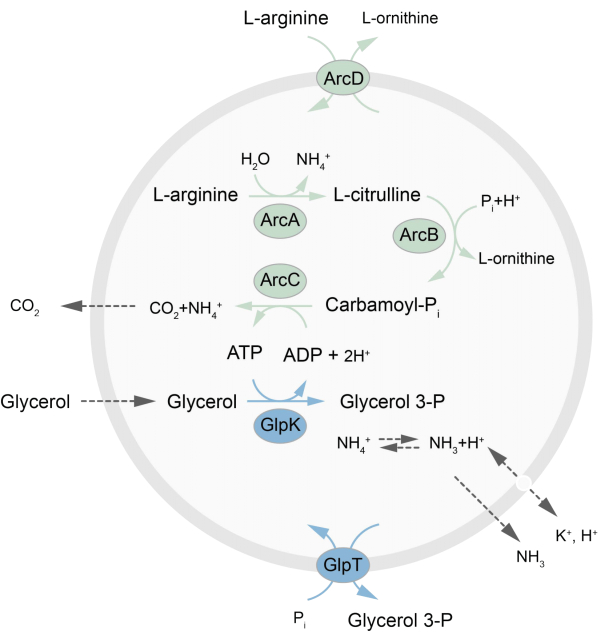
Figura 1: Panoramica della via per la produzione di ATP e la sintesi e l’escrezione del glicerolo-3-fosfato. Clicca qui per visualizzare una versione più grande di questa figura.
In breve, le proteine di membrana purificate (solubilizzate in dodecil-β-D-maltoside, DDM) vengono aggiunte alle vescicole lipidiche preformate che sono state destabilizzate con Triton X-100, che consente l’inserimento delle proteine nella membrana. Le molecole detergenti vengono successivamente (lentamente) rimosse mediante l’aggiunta di perle di polistirene attivate, con conseguente formazione di proteoliposomi ben sigillati. I componenti solubili possono quindi essere aggiunti alle vescicole e incapsulati tramite cicli di congelamento-scongelamento, che intrappolano le molecole nel processo di fusione della membrana. Le vescicole ottenute sono altamente eterogenee e molte sono multilamellari. Vengono quindi estrusi attraverso un filtro in policarbonato con una dimensione dei pori di 400, 200 o 100 nm, che produce vescicole di dimensioni più uniformi; Più piccola è la dimensione dei pori, più omogenee e unilamellari sono le vescicole ma al prezzo di un volume interno inferiore. Le proteine non incorporate e le piccole molecole vengono rimosse dalla soluzione esterna mediante cromatografia ad esclusione dimensionale. I proteoLUV possono essere convertiti in vescicole di dimensioni micrometriche mediante rigonfiamento assistito da gel, e questi proteoGUV vengono quindi raccolti e intrappolati in un chip microfluidico per la caratterizzazione e la manipolazione microscopica. La Figura 2 mostra una panoramica schematica dell’intero protocollo.
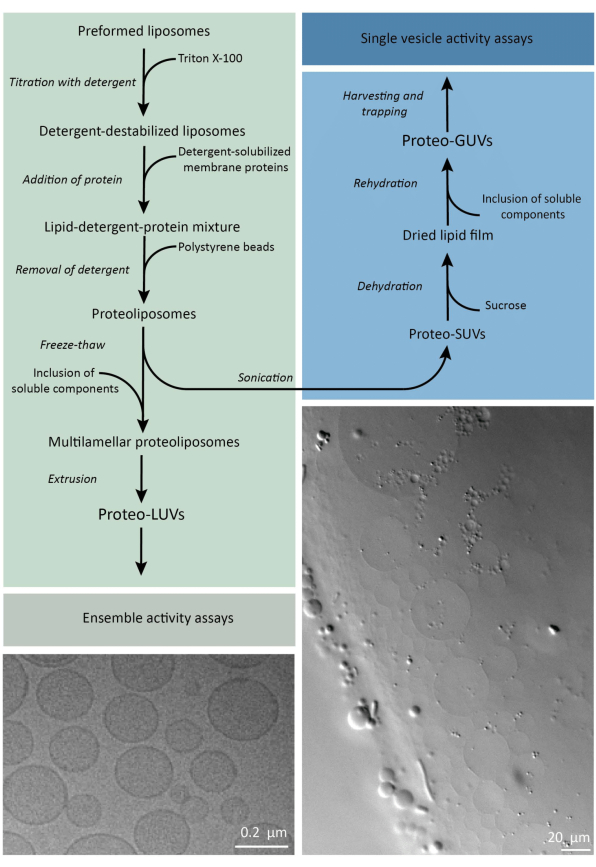
Figura 2: Panoramica del protocollo per la ricostituzione delle proteine di membrana e l’incapsulamento degli enzimi e dei componenti idrosolubili in vescicole lipidiche di dimensioni sub-micrometriche (LUV) e micrometriche (GUV). Fare clic qui per visualizzare una versione più grande di questa figura.
I protocolli di ricostituzione e incapsulamento funzionano bene e la funzionalità delle proteine viene mantenuta, ma i proteoLUV e i proteoGUV sono di dimensioni eterogenee. Gli approcci microfluidici31,32 consentono la formazione di vescicole di dimensioni micrometriche di dimensioni più omogenee, ma la ricostituzione funzionale delle proteine di membrana non è generalmente possibile perché il solvente residuo nel doppio strato inattiva le proteine. Le dimensioni dei proteoLUV variano da 100 a 400 nm e, a basse concentrazioni di enzimi, l’incapsulamento può portare a vescicole con vie metaboliche incomplete (effetti stocastici; vedi Figura 3). I LUV sono ideali per la costruzione di specifici moduli metabolici, come mostrato qui per la produzione di ATP e di elementi costitutivi come il G3P. Tali proteoLUV possono potenzialmente essere incapsulati in GUV e fungere da compartimenti simili a organelli per le vescicole dell’ospite.
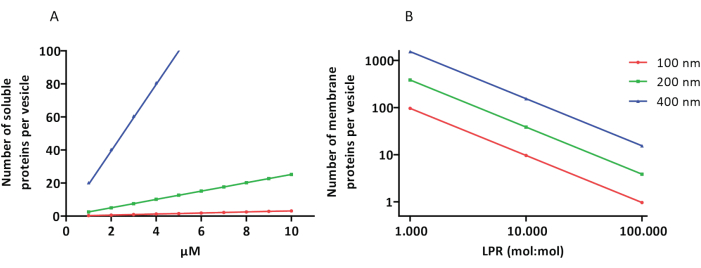
Figura 3: Numero di molecole per vescicola con un diametro di 100, 200 o 400 nm. (A) Quando le proteine incapsulate (enzimi, sonde) sono nell’intervallo 1-10 μM. (B) La ricostituzione viene eseguita a 1-1.000, da 1 a 10.000 e da 1 a 100.000 proteine di membrana per lipide (mol/mol). Partiamo dal presupposto che le molecole siano incapsulate alle concentrazioni indicate e incorporate nella membrana a questi rapporti proteina-lipide. Per alcuni enzimi, abbiamo visto che si legano alle membrane, che possono aumentare la loro concentrazione apparente nelle vescicole. Abbreviazione: LPR = Rapporto lipidico-proteico Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Presentiamo un protocollo per la sintesi di proteine (di membrana) contenenti vescicole lipidiche di dimensioni sub-micrometriche (proteoLUVs), e la conversione di proteoLUV in vescicole giganti-unilamellari (proteoGUVs). Il protocollo dovrebbe essere applicabile per la ricostituzione di altre proteine di membrana 13,19,30,40 e l’incapsulamento di reti metaboliche diverse dalle vie di degradazione della L-arginina e di sintesi del glicerolo 3-fosfato qui presentate.</s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori ringraziano Aditya Iyer per la clonazione del gene pBAD-PercevalHR e Gea Schuurman-Wolters per aver contribuito alla produzione e alla purificazione delle proteine. La ricerca è stata finanziata dal programma di gravitazione NWO “Building a Synthetic Cell” (BaSyC).
Materials
| Agarose | Sigma Aldrich | A9414-25g | |
| Amicon cut-off filter | Sigma Aldrich | Milipore centrifugal filter units Amicon Ultra | |
| BioBeads | BioRad | 152-3920 | |
| CHCl3 | Macron Fine Chemicals | MFCD00000826 | |
| D(+)-Glucose | Formedium | – | |
| D(+)-Sucrose | Formedium | – | |
| DDM | Glycon | D97002 -C | |
| Diethyl Ether | Biosolve | 52805 | |
| DMSO | Sigma-Aldrich | 276855-100ml | |
| DOPC | Avanti | 850375P-1g | |
| DOPE | Avanti | 850725P-1g | |
| DOPG | Avanti | 840475P-1g | |
| DTT | Formedium | DTT005 | |
| EtOH | J.T.Baker Avantor | MFCD00003568 | |
| Extruder | Avestin Inc | LF-1 | |
| Fluorimeter | Jasco | Spectrofluorometer FP-8300 | |
| Glycerol | BOOM | 51171608 | |
| Gravity flow column | Bio-Rad | 732-1010 | |
| Hamilton syringe 100 µL | Hamilton | 7656-01 | |
| Hamilton syringe 1000 µL | Hamilton | 81320 | |
| Handheld LCP dispenser | Art Robbins Instruments | 620-411-00 | |
| Handheld Sonicator | Hielscher Ultrasound Technology | UP50H | |
| HCl | BOOM | x76021889.1000 | |
| Imidazole | Roth | X998.4-250g | |
| K2HPO4 | Supelco | 1.05099.1000 | |
| KCl | BOOM | 76028270.1 | |
| KH2PO4 | Supelco | 1.04873.1000 | |
| Kimwipe | Kimtech Science | 7552 | |
| Large Falcon tube centrifuge | Eppendorf | Centrifuge 5810 R | |
| L-Arginine | Sigma-Aldrich | A5006-100G | |
| Light microscope | Leica | DM LS2 | |
| L-Ornithine | Roth | T204.1 | |
| LSM Laser Scanning Confocal Microscope | Zeiss | LSM 710 ConfoCor 3 | |
| MgCl2 | Sigma-Aldrich | M2670-1KG | |
| Microfluidic chip | Homemade | PDMS based | DOI: https://doi.org/10.1039/C8LC01275J |
| Na-ADP | Sigma-Aldrich | A2754-1G | |
| NaCl | Supelco | 1.06404.1000 | |
| Nanodrop Spectrometer | Isogen Life Science | ND-1000 spectrophotometer NanoDrop | |
| NaOH | Supelco | 1.06498.1000 | |
| Needles for GUVs | Henke-Ject | 14-14575 | 27 G x 3/4'' 0.4 x 20 mm |
| Needles for microfluidics | Henke-Ject | 14-15538 | 18 G x 1 1/2'' 1.2 x 40 mm |
| Ni2+ Sepharose | Cytiva | 17526802 | |
| Nigericin | Sigma-Aldrich | N7143-5MG | |
| Nutator | VWR | 83007-210 | |
| Osmolality meter | Gonotec Salmenkipp | Osmomat 3000 basic freezing point osmometer | |
| Plasmacleaner | Plasma Etch | PE-Avenger | |
| Polycarbonate filter | Cytiva Whatman | Nuclepor Track-Etch Membrane Product: 10417104 | 0.4 µm |
| Polycarbonate ultracentrifuge tube | Beckman Coulter | 355647 | |
| Pyranine | Acros Organics | H1529-1G | |
| Quartz cuvette (black) | Hellma Analytics | 108B-10-40 | |
| Sephadex G-75 resin | GE Healthcare | 17-0050-01 | |
| Sonicator | Sonics Sonics & Materials INC | Sonics vibra cell | |
| Syringe filter | Sarstedt | Filtropur S plus 0.2 | 0.2 µm |
| Syringe pump | Harvard Apparatus | A-42467 | |
| Tabletop centrifuge | Eppendorf | centrifuge 5418 | |
| Teflon spacer | Homemade | Teflon based | 45 x 26 x 1.5 or 45 x 26 x 3 or 20 x 20 x 3 mm |
| Tris | PanReac AppliChem | A1086.1000 | |
| Triton X-100 | Sigma Aldrich | T8787-100 ml | |
| Ultracentrifuge | Beckman Coulter | Optima Max-E | |
| UV lamp | Spectroline | ENB-280C/FE | |
| UV/VIS Spectrometer | Jasco | V730 spectrophotometer | |
| Valinomycin | Sigma-Aldrich | V0627-10MG | |
| Widefield fluorescence microscope | Zeiss | AxioObserver | |
| β-Casein | Sigma Aldrich | C5890-500g |
References
- Hirschi, S., Ward, T. R., Meier, W. P., Müller, D. J., Fotiadis, D. Synthetic biology: bottom-up assembly of molecular systems. Chem Rev. 122 (21), 16294-16328 (2022).
- Ivanov, I., et al. Bottom-up synthesis of artificial cells: recent highlights and future challenges. Annu Rev Chem Biomol. Eng. 12 (1), 287-308 (2021).
- Clomburg, J. M., Crumbley, A. M., Gonzalez, R. Industrial biomanufacturing: The future of chemical production. Science. 355 (6320), (2017).
- Shi, T., Han, P., You, C., Zhang, Y. -. H. P. J. An in vitro synthetic biology platform for emerging industrial biomanufacturing: Bottom-up pathway design. Synth Syst Biotechnol. 3 (3), 186-195 (2018).
- Wang, A., et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater. 30 (13), 1910168 (2020).
- Kanter, G., et al. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood. 109 (8), 3393-3399 (2007).
- Zeltins, A. Construction and characterization of virus-like particles: a review. Mol Biotechnol. 53 (1), 92-107 (2013).
- Jain, K. K. Synthetic biology and personalized medicine. Med Princ Pract. 22 (3), 209-219 (2013).
- Schwille, P., Frohn, B. P. Hidden protein functions and what they may teach us. Trends Cell Biol. 32 (2), 102-109 (2022).
- Sachsenmeier, P. Industry 5.0-The relevance and implications of bionics and synthetic biology. Engineering. 2 (2), 225-229 (2016).
- Schmidt, D., Jiang, Q. -. X., MacKinnon, R. Phospholipids and the origin of cationic gating charges in voltage sensors. Nature. 444 (7120), 775-779 (2006).
- Godoy-Hernandez, A., et al. Rapid and highly stable membrane reconstitution by LAiR enables the study of physiological integral membrane protein functions. ACS Cent Sci. 9 (3), 494-507 (2023).
- Sikkema, H. R., et al. Gating by ionic strength and safety check by cyclic-di-AMP in the ABC transporter OpuA. Sci Adv. 6 (47), 7697 (2020).
- Foucaud, C., Poolman, B. Lactose transport system of Streptococcus thermophilus. Functional reconstitution of the protein and characterization of the kinetic mechanism of transport. J Biol Chem. 267 (31), 22087-22094 (1992).
- Yoneda, J. S., Sebinelli, H. G., Itri, R., Ciancaglini, P. Overview on solubilization and lipid reconstitution of Na,K-ATPase: enzyme kinetic and biophysical characterization. Biophys Rev. 12 (1), 49-64 (2020).
- Simidjiev, I., et al. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci. 97 (4), 1473-1476 (2000).
- Harris, N. J., Booth, P. J. Folding and stability of membrane transport proteins in vitro. Biochim Biophys Acta BBA – Biomembr. 1818 (4), 1055-1066 (2012).
- Jackson, M. L., Litman, B. J. Rhodopsin-egg phosphatidylcholine reconstitution by an octyl glucoside dilution procedure. Biochim Biophys Acta BBA – Biomembr. 812 (2), 369-376 (1985).
- Geertsma, E. R., Nik Mahmood, N. A. B., Schuurman-Wolters, G. K., Poolman, B. Membrane reconstitution of ABC transporters and assays of translocator function. Nat Protoc. 3 (2), 256-266 (2008).
- Rigaud, J. -. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochim Biophys Acta BBA – Bioenerg. 1231 (3), 223-246 (1995).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc Natl Acad Sci. 75 (9), 4194-4198 (1978).
- . Synthetic Organelles for Energy Conservation and Delivery of Building Blocks for Lipid Biosynthesis Available from: https://www.researchsquare.com/article/rs-3385355/v1 (2023)
- Lee, K. Y., et al. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nat Biotechnol. 36 (6), 530-535 (2018).
- Méléard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation. Methods in Enzymology. , 161-176 (2009).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J. Vis. Exp. (95), e52281 (2015).
- Doeven, M. K., et al. lateral mobility and function of membrane proteins incorporated into giant unilamellar vesicles. Biophys J. 88 (2), 1134-1142 (2005).
- Pols, T., et al. A synthetic metabolic network for physicochemical homeostasis. Nat Commun. 10 (1), 4239 (2019).
- Bailoni, E., Poolman, B. ATP recycling fuels sustainable glycerol 3-phosphate formation in synthetic cells fed by dynamic dialysis. ACS Synth Biol. 11 (7), 2348-2360 (2022).
- Van Der Heide, T. On the osmotic signal and osmosensing mechanism of an ABC transport system for glycine betaine. EMBO J. 20 (24), 7022-7032 (2001).
- Van’T Klooster, J. S., et al. Membrane lipid requirements of the lysine transporter Lyp1 from Saccharomyces cerevisiae. J Mol Biol. 432 (14), 4023-4031 (2020).
- Lou, G., Anderluzzi, G., Woods, S., Roberts, C. W., Perrie, Y. A novel microfluidic-based approach to formulate size-tuneable large unilamellar cationic liposomes: Formulation, cellular uptake and biodistribution investigations. Eur J Pharm Biopharm. 143, 51-60 (2019).
- Weiss, M., et al. Sequential bottom-up assembly of mechanically stabilized synthetic cells by microfluidics. Nat Mater. 17 (1), 89-96 (2018).
- Pols, T., Singh, S., Deelman-Driessen, C., Gaastra, B. F., Poolman, B. Enzymology of the pathway for ATP production by arginine breakdown. FEBS J. 288 (1), 293-309 (2021).
- Yandrapalli, N., Robinson, T. Ultra-high capacity microfluidic trapping of giant vesicles for high-throughput membrane studies. Lab Chip. 19 (4), 626-633 (2019).
- Elias, M., et al. Microfluidic characterization of biomimetic membrane mechanics with an on-chip micropipette. Micro Nano Eng. 8, 100064 (2020).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 044105 (2013).
- Cooper, A., Girish, V., Subramaniam, A. B. Osmotic Pressure Enables High-Yield Assembly of Giant Vesicles in Solutions of Physiological Ionic Strengths. Langmuir. 39 (15), 5579-5590 (2023).
- Tantama, M., Martínez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4 (1), 2550 (2013).
- Setyawati, I., et al. In vitro reconstitution of dynamically interacting integral membrane subunits of energy-coupling factor transporters. eLife. 9, e64389 (2020).
- Oropeza-Guzman, E., Ríos-Ramírez, M., Ruiz-Suárez, J. C. Leveraging the coffee ring effect for a defect-free electroformation of giant unilamellar vesicles. Langmuir. 35 (50), 16528-16535 (2019).
- Estes, D. J., Mayer, M. Electroformation of giant liposomes from spin-coated films of lipids. Colloids Surf B Biointerfaces. 42 (2), 115-123 (2005).

.
