Konstruksjon av metabolske nettverk utenfor likevekt i vesikler i nano- og mikrometerstørrelse
Summary
Vi presenterer en protokoll for rekonstituering av membranproteiner og innkapsling av enzymer og andre vannløselige komponenter i lipidvesikler av submikrometer- og mikrometerstørrelse.
Abstract
Vi presenterer en metode for å inkorporere komplekse proteinnettverk i vesikler, som involverer integrerte membranproteiner, enzymer og fluorescensbaserte sensorer, ved bruk av rensede komponenter. Denne metoden er relevant for design og konstruksjon av bioreaktorer og studiet av komplekse metabolske reaksjonsnettverk utenfor likevekt. Vi starter med å rekonstituere (flere) membranproteiner til store unilamellære vesikler (LUV) i henhold til en tidligere utviklet protokoll. Vi innkapsler deretter en blanding av rensede enzymer, metabolitter og fluorescensbaserte sensorer (fluorescerende proteiner eller fargestoffer) via fryse-tine-ekstrudering og fjerne ikke-inkorporerte komponenter ved sentrifugering og/eller størrelseseksklusjonskromatografi. Ytelsen til de metabolske nettverkene måles i sanntid ved å overvåke ATP/ADP-forholdet, metabolittkonsentrasjonen, intern pH eller andre parametere ved fluorescensavlesning. Våre membranproteinholdige vesikler med en diameter på 100-400 nm kan omdannes til gigantiske unilamellære vesikler (GUV), ved å bruke eksisterende, men optimaliserte prosedyrer. Tilnærmingen muliggjør inkludering av løselige komponenter (enzymer, metabolitter, sensorer) i mikrometerstore vesikler, og oppskalerer dermed volumet av bioreaktorene med størrelsesordener. Det metabolske nettverket som inneholder GUV-er er fanget i mikrofluidiske enheter for analyse ved optisk mikroskopi.
Introduction
Feltet nedenfra og opp syntetisk biologi fokuserer på å konstruere (minimale) celler 1,2 og metabolske bioreaktorer for bioteknologiske 3,4 eller biomedisinske formål 5,6,7,8. Konstruksjonen av syntetiske celler gir en unik plattform som lar forskere studere (membran) proteiner under veldefinerte forhold som etterligner de i innfødte miljøer, noe som muliggjør oppdagelsen av fremvoksende egenskaper og skjulte biokjemiske funksjoner til proteiner og reaksjonsnettverk9. Som et mellomtrinn mot en autonomt fungerende syntetisk celle, utvikles moduler som fanger opp essensielle trekk ved levende celler som metabolsk energibevaring, protein- og lipidsyntese og homeostase. Slike moduler forbedrer ikke bare vår forståelse av livet, men har også potensielle anvendelser innen medisin8 og bioteknologi10.
Transmembrane proteiner er kjernen i praktisk talt ethvert metabolsk nettverk når de transporterer molekyler inn eller ut av cellen, signaliserer og reagerer på kvaliteten på miljøet, og spiller en rekke biosyntetiske roller. Dermed krever konstruksjonen av metabolske moduler i syntetiske celler i de fleste tilfeller rekonstituering av integrerte og/eller perifere membranproteiner til et membrandobbeltlag sammensatt av spesifikke lipider og høy integritet (lav permeabilitet). Håndteringen av disse membranproteinene er utfordrende og krever spesifikk kunnskap og eksperimentelle ferdigheter.
Flere metoder er utviklet for å rekonstituere membranproteiner i fosfolipidvesikler, oftest med det formål å studere funksjonen11,12, regulering13, kinetiske egenskaper14,15, lipidavhengighet15,16 og/eller stabilitet17 til et spesifikt protein. Disse metodene involverer rask fortynning av vaskemiddeloppløst protein til vandige medier i nærvær av lipider18, fjerning av vaskemidler ved å inkubere vaskemiddeloppløselig protein med vaskemiddeldestabiliserte lipidvesikler og absorpsjon av vaskemiddel(e) på polystyrenperler19, eller fjerning av vaskemidler ved dialyse eller størrelseseksklusjonskromatografi20. Organiske løsningsmidler har blitt brukt til å danne lipidvesikler, for eksempel via dannelse av olje-vann-interfaser21, men flertallet av integrerte membranproteiner inaktiveres når de utsettes for slike løsningsmidler.
I laboratoriet vårt rekonstituerer vi for det meste membranproteiner ved vaskemiddelabsorpsjonsmetoden for å danne store unilamellære vesikler (LUV)19. Denne metoden tillater samrekonstituering av flere membranproteiner og innkapsling i vesikkellumen av enzymer, metabolitter og sonder22,23. De membranproteinholdige LUV-ene kan omdannes til gigantiske unilamellære vesikler (GUV) med/uten innkapsling av vannløselige komponenter, ved bruk av enten elektroformasjon24 eller gelassistert hevelse25 og spesifikke forhold for å bevare integriteten til membranproteinene26.
Denne artikkelen presenterer en protokoll for rekonstituering i LUV-er av et metabolsk nettverk utenfor likevekt som regenererer ATP gjennom nedbrytning av L-arginin til L-ornitin27. Dannelsen av ATP er koblet til produksjonen av glyserol-3-fosfat (G3P), en viktig byggestein for fosfolipidsyntese22,28. Den metabolske veien består av to integrerte membranproteiner, en arginin/ornitin (ArcD) og en G3P/Pi-antiporter (GlpT). I tillegg kreves tre løselige enzymer (ArcA, ArcB, ArcC) for resirkulering av ATP, og GlpK brukes til å omdanne glyserol til glyserol 3-fosfat, ved bruk av ATP fra nedbrytningen av L-arginin, se figur 1 for en skjematisk oversikt over banen. Denne protokollen representerer et godt utgangspunkt for fremtidig konstruksjon av enda mer komplekse reaksjonsnettverk – for syntese av lipider eller proteiner eller deling av celler. Lipidsammensetningen til vesiklene støtter aktiviteten til et bredt utvalg av integrerte membranproteiner og er optimalisert for transport av forskjellige molekyler inn i eller ut av vesiklene 27,29,30.
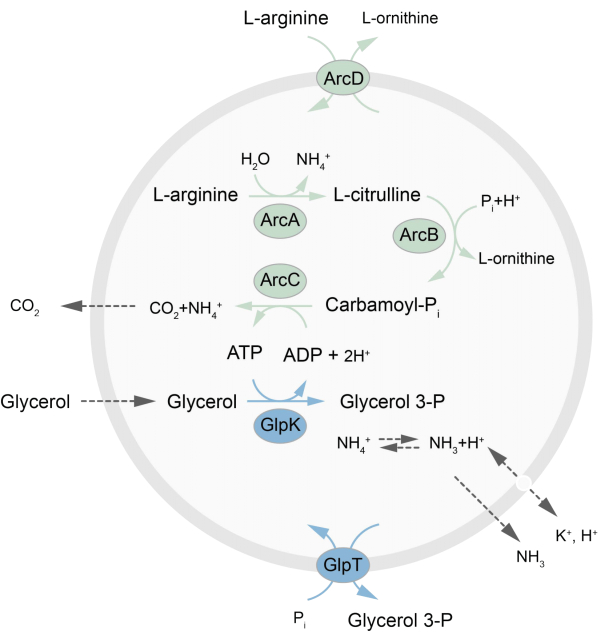
Figur 1: Oversikt over veien for ATP-produksjon og syntese og utskillelse av glyserol 3-fosfat, klikk her for å se en større versjon av denne figuren.
Kort sagt, rensede membranproteiner (oppløst i dodecyl-β-D-maltosid, DDM) tilsettes til forhåndsformede lipidvesikler som har blitt destabilisert med Triton X-100, noe som gjør det mulig å sette inn proteinene i membranen. Vaskemiddelmolekylene fjernes deretter (sakte) ved tilsetning av aktiverte polystyrenperler, noe som resulterer i dannelse av godt forseglede proteoliposomer. Løselige komponenter kan deretter tilsettes vesiklene og innkapsles via fryse-tine-sykluser, som fanger molekylene i prosessen med membranfusjon. De oppnådde vesiklene er svært heterogene og mange er multilamellære. De ekstruderes deretter gjennom et polykarbonatfilter med en porestørrelse på 400, 200 eller 100 nm, noe som gir mer jevne vesikler; Jo mindre porestørrelsen er, desto mer homogene og unilamellære er vesiklene, men til prisen av et mindre indre volum. Ikke-inkorporerte proteiner og små molekyler fjernes fra den eksterne løsningen ved størrelseseksklusjonskromatografi. ProteoGUL-ene kan omdannes til vesikler i mikrometerstørrelse ved gelassistert hevelse, og disse proteoGUVene blir deretter samlet og fanget i en mikrofluidisk brikke for mikroskopisk karakterisering og manipulasjon. Figur 2 viser en skjematisk oversikt over hele protokollen.
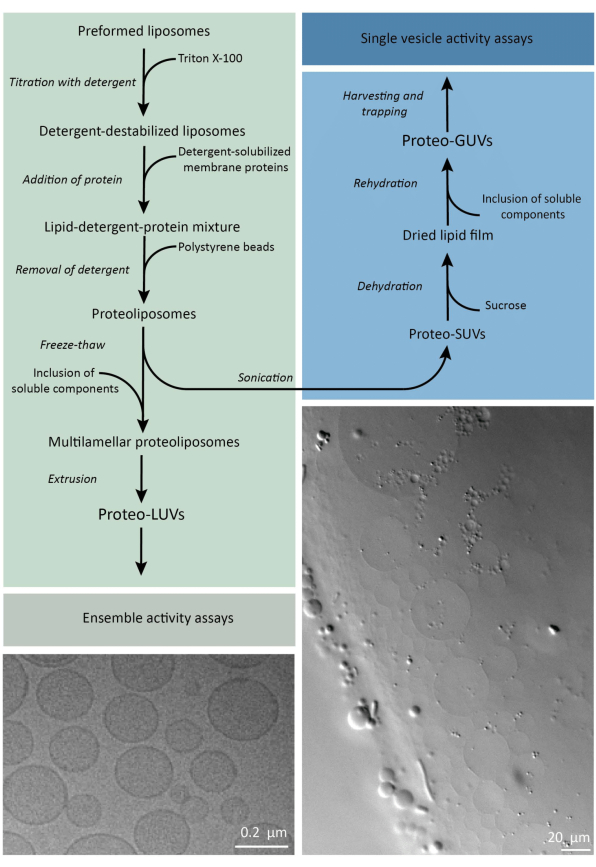
Figur 2: Oversikt over protokollen for rekonstituering av membranproteiner og innkapsling av enzymer og vannløselige komponenter i lipidvesikler av submikrometer (UV) og mikrometerstørrelse (GUV). Klikk her for å se en større versjon av denne figuren.
Rekonstituerings- og innkapslingsprotokollene fungerer bra og funksjonaliteten til proteinene beholdes, men proteoGUL-ene og proteoGUV-ene er heterogene i størrelse. Mikrofluidiske tilnærminger 31,32 tillater dannelse av vesikler i mikrometerstørrelse som er mer homogene i størrelse, men funksjonell rekonstituering av membranproteiner er generelt ikke mulig fordi gjenværende løsningsmiddel i dobbeltlaget inaktiverer proteinene. ProteoLÚVene varierer i størrelse fra 100 til 400 nm, og ved lave konsentrasjoner av enzymer kan innkapslingen føre til vesikler med ufullstendige metabolske veier (stokastiske effekter; se figur 3). LUV-er er ideelle for å konstruere spesifikke metabolske moduler, som vist her for produksjon av ATP og byggesteiner som G3P. Slike proteoLIV-er kan potensielt innkapsles i GUV-er og tjene som organelllignende rom for vertsvesiklene.
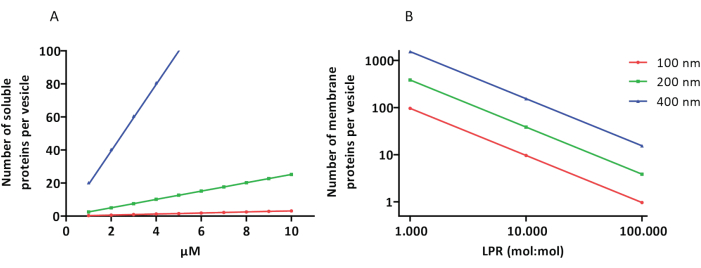
Figur 3: Antall molekyler per vesikkel med en diameter på 100, 200 eller 400 nm. (A) Når de innkapslede proteinene (enzymer, prober) er i området 1-10 μM. (B) Rekonstitueringen gjøres ved 1 til 1 000, 1 til 10 000 og 1 til 100 000 membranproteiner per lipid (mol/mol). Vi antar at molekyler er innkapslet i de angitte konsentrasjonene og inkorporert i membranen ved disse protein-til-lipid-forholdene. For noen enzymer har vi sett at de binder seg til membraner, noe som kan øke deres tilsynelatende konsentrasjon i vesiklene. Forkortelse: LPR = Lipid-Protein-Ratio Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Vi presenterer en protokoll for syntese av (membran)protein som inneholder lipidvesikler i submikrometerstørrelse (proteoGUL), og konvertering av proteoLÚVer til gigantiske unilamellære vesikler (proteoGUV). Protokollen bør gjelde for rekonstituering av andre membranproteiner 13,19,30,40 og innkapsling av andre metabolske nettverk enn L-arginin-nedbrytningen og glyserol-3-fosfatsynteseveiene presentert her.<sup cl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Aditya Iyer for kloningen av pBAD-PercevalHR-genet og Gea Schuurman-Wolters for å hjelpe til med proteinproduksjon og rensing. Forskningen ble finansiert av NWOs gravitasjonsprogram “Building a Synthetic Cell” (BaSyC).
Materials
| Agarose | Sigma Aldrich | A9414-25g | |
| Amicon cut-off filter | Sigma Aldrich | Milipore centrifugal filter units Amicon Ultra | |
| BioBeads | BioRad | 152-3920 | |
| CHCl3 | Macron Fine Chemicals | MFCD00000826 | |
| D(+)-Glucose | Formedium | – | |
| D(+)-Sucrose | Formedium | – | |
| DDM | Glycon | D97002 -C | |
| Diethyl Ether | Biosolve | 52805 | |
| DMSO | Sigma-Aldrich | 276855-100ml | |
| DOPC | Avanti | 850375P-1g | |
| DOPE | Avanti | 850725P-1g | |
| DOPG | Avanti | 840475P-1g | |
| DTT | Formedium | DTT005 | |
| EtOH | J.T.Baker Avantor | MFCD00003568 | |
| Extruder | Avestin Inc | LF-1 | |
| Fluorimeter | Jasco | Spectrofluorometer FP-8300 | |
| Glycerol | BOOM | 51171608 | |
| Gravity flow column | Bio-Rad | 732-1010 | |
| Hamilton syringe 100 µL | Hamilton | 7656-01 | |
| Hamilton syringe 1000 µL | Hamilton | 81320 | |
| Handheld LCP dispenser | Art Robbins Instruments | 620-411-00 | |
| Handheld Sonicator | Hielscher Ultrasound Technology | UP50H | |
| HCl | BOOM | x76021889.1000 | |
| Imidazole | Roth | X998.4-250g | |
| K2HPO4 | Supelco | 1.05099.1000 | |
| KCl | BOOM | 76028270.1 | |
| KH2PO4 | Supelco | 1.04873.1000 | |
| Kimwipe | Kimtech Science | 7552 | |
| Large Falcon tube centrifuge | Eppendorf | Centrifuge 5810 R | |
| L-Arginine | Sigma-Aldrich | A5006-100G | |
| Light microscope | Leica | DM LS2 | |
| L-Ornithine | Roth | T204.1 | |
| LSM Laser Scanning Confocal Microscope | Zeiss | LSM 710 ConfoCor 3 | |
| MgCl2 | Sigma-Aldrich | M2670-1KG | |
| Microfluidic chip | Homemade | PDMS based | DOI: https://doi.org/10.1039/C8LC01275J |
| Na-ADP | Sigma-Aldrich | A2754-1G | |
| NaCl | Supelco | 1.06404.1000 | |
| Nanodrop Spectrometer | Isogen Life Science | ND-1000 spectrophotometer NanoDrop | |
| NaOH | Supelco | 1.06498.1000 | |
| Needles for GUVs | Henke-Ject | 14-14575 | 27 G x 3/4'' 0.4 x 20 mm |
| Needles for microfluidics | Henke-Ject | 14-15538 | 18 G x 1 1/2'' 1.2 x 40 mm |
| Ni2+ Sepharose | Cytiva | 17526802 | |
| Nigericin | Sigma-Aldrich | N7143-5MG | |
| Nutator | VWR | 83007-210 | |
| Osmolality meter | Gonotec Salmenkipp | Osmomat 3000 basic freezing point osmometer | |
| Plasmacleaner | Plasma Etch | PE-Avenger | |
| Polycarbonate filter | Cytiva Whatman | Nuclepor Track-Etch Membrane Product: 10417104 | 0.4 µm |
| Polycarbonate ultracentrifuge tube | Beckman Coulter | 355647 | |
| Pyranine | Acros Organics | H1529-1G | |
| Quartz cuvette (black) | Hellma Analytics | 108B-10-40 | |
| Sephadex G-75 resin | GE Healthcare | 17-0050-01 | |
| Sonicator | Sonics Sonics & Materials INC | Sonics vibra cell | |
| Syringe filter | Sarstedt | Filtropur S plus 0.2 | 0.2 µm |
| Syringe pump | Harvard Apparatus | A-42467 | |
| Tabletop centrifuge | Eppendorf | centrifuge 5418 | |
| Teflon spacer | Homemade | Teflon based | 45 x 26 x 1.5 or 45 x 26 x 3 or 20 x 20 x 3 mm |
| Tris | PanReac AppliChem | A1086.1000 | |
| Triton X-100 | Sigma Aldrich | T8787-100 ml | |
| Ultracentrifuge | Beckman Coulter | Optima Max-E | |
| UV lamp | Spectroline | ENB-280C/FE | |
| UV/VIS Spectrometer | Jasco | V730 spectrophotometer | |
| Valinomycin | Sigma-Aldrich | V0627-10MG | |
| Widefield fluorescence microscope | Zeiss | AxioObserver | |
| β-Casein | Sigma Aldrich | C5890-500g |
References
- Hirschi, S., Ward, T. R., Meier, W. P., Müller, D. J., Fotiadis, D. Synthetic biology: bottom-up assembly of molecular systems. Chem Rev. 122 (21), 16294-16328 (2022).
- Ivanov, I., et al. Bottom-up synthesis of artificial cells: recent highlights and future challenges. Annu Rev Chem Biomol. Eng. 12 (1), 287-308 (2021).
- Clomburg, J. M., Crumbley, A. M., Gonzalez, R. Industrial biomanufacturing: The future of chemical production. Science. 355 (6320), (2017).
- Shi, T., Han, P., You, C., Zhang, Y. -. H. P. J. An in vitro synthetic biology platform for emerging industrial biomanufacturing: Bottom-up pathway design. Synth Syst Biotechnol. 3 (3), 186-195 (2018).
- Wang, A., et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater. 30 (13), 1910168 (2020).
- Kanter, G., et al. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood. 109 (8), 3393-3399 (2007).
- Zeltins, A. Construction and characterization of virus-like particles: a review. Mol Biotechnol. 53 (1), 92-107 (2013).
- Jain, K. K. Synthetic biology and personalized medicine. Med Princ Pract. 22 (3), 209-219 (2013).
- Schwille, P., Frohn, B. P. Hidden protein functions and what they may teach us. Trends Cell Biol. 32 (2), 102-109 (2022).
- Sachsenmeier, P. Industry 5.0-The relevance and implications of bionics and synthetic biology. Engineering. 2 (2), 225-229 (2016).
- Schmidt, D., Jiang, Q. -. X., MacKinnon, R. Phospholipids and the origin of cationic gating charges in voltage sensors. Nature. 444 (7120), 775-779 (2006).
- Godoy-Hernandez, A., et al. Rapid and highly stable membrane reconstitution by LAiR enables the study of physiological integral membrane protein functions. ACS Cent Sci. 9 (3), 494-507 (2023).
- Sikkema, H. R., et al. Gating by ionic strength and safety check by cyclic-di-AMP in the ABC transporter OpuA. Sci Adv. 6 (47), 7697 (2020).
- Foucaud, C., Poolman, B. Lactose transport system of Streptococcus thermophilus. Functional reconstitution of the protein and characterization of the kinetic mechanism of transport. J Biol Chem. 267 (31), 22087-22094 (1992).
- Yoneda, J. S., Sebinelli, H. G., Itri, R., Ciancaglini, P. Overview on solubilization and lipid reconstitution of Na,K-ATPase: enzyme kinetic and biophysical characterization. Biophys Rev. 12 (1), 49-64 (2020).
- Simidjiev, I., et al. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci. 97 (4), 1473-1476 (2000).
- Harris, N. J., Booth, P. J. Folding and stability of membrane transport proteins in vitro. Biochim Biophys Acta BBA – Biomembr. 1818 (4), 1055-1066 (2012).
- Jackson, M. L., Litman, B. J. Rhodopsin-egg phosphatidylcholine reconstitution by an octyl glucoside dilution procedure. Biochim Biophys Acta BBA – Biomembr. 812 (2), 369-376 (1985).
- Geertsma, E. R., Nik Mahmood, N. A. B., Schuurman-Wolters, G. K., Poolman, B. Membrane reconstitution of ABC transporters and assays of translocator function. Nat Protoc. 3 (2), 256-266 (2008).
- Rigaud, J. -. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochim Biophys Acta BBA – Bioenerg. 1231 (3), 223-246 (1995).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc Natl Acad Sci. 75 (9), 4194-4198 (1978).
- . Synthetic Organelles for Energy Conservation and Delivery of Building Blocks for Lipid Biosynthesis Available from: https://www.researchsquare.com/article/rs-3385355/v1 (2023)
- Lee, K. Y., et al. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nat Biotechnol. 36 (6), 530-535 (2018).
- Méléard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation. Methods in Enzymology. , 161-176 (2009).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J. Vis. Exp. (95), e52281 (2015).
- Doeven, M. K., et al. lateral mobility and function of membrane proteins incorporated into giant unilamellar vesicles. Biophys J. 88 (2), 1134-1142 (2005).
- Pols, T., et al. A synthetic metabolic network for physicochemical homeostasis. Nat Commun. 10 (1), 4239 (2019).
- Bailoni, E., Poolman, B. ATP recycling fuels sustainable glycerol 3-phosphate formation in synthetic cells fed by dynamic dialysis. ACS Synth Biol. 11 (7), 2348-2360 (2022).
- Van Der Heide, T. On the osmotic signal and osmosensing mechanism of an ABC transport system for glycine betaine. EMBO J. 20 (24), 7022-7032 (2001).
- Van’T Klooster, J. S., et al. Membrane lipid requirements of the lysine transporter Lyp1 from Saccharomyces cerevisiae. J Mol Biol. 432 (14), 4023-4031 (2020).
- Lou, G., Anderluzzi, G., Woods, S., Roberts, C. W., Perrie, Y. A novel microfluidic-based approach to formulate size-tuneable large unilamellar cationic liposomes: Formulation, cellular uptake and biodistribution investigations. Eur J Pharm Biopharm. 143, 51-60 (2019).
- Weiss, M., et al. Sequential bottom-up assembly of mechanically stabilized synthetic cells by microfluidics. Nat Mater. 17 (1), 89-96 (2018).
- Pols, T., Singh, S., Deelman-Driessen, C., Gaastra, B. F., Poolman, B. Enzymology of the pathway for ATP production by arginine breakdown. FEBS J. 288 (1), 293-309 (2021).
- Yandrapalli, N., Robinson, T. Ultra-high capacity microfluidic trapping of giant vesicles for high-throughput membrane studies. Lab Chip. 19 (4), 626-633 (2019).
- Elias, M., et al. Microfluidic characterization of biomimetic membrane mechanics with an on-chip micropipette. Micro Nano Eng. 8, 100064 (2020).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 044105 (2013).
- Cooper, A., Girish, V., Subramaniam, A. B. Osmotic Pressure Enables High-Yield Assembly of Giant Vesicles in Solutions of Physiological Ionic Strengths. Langmuir. 39 (15), 5579-5590 (2023).
- Tantama, M., Martínez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4 (1), 2550 (2013).
- Setyawati, I., et al. In vitro reconstitution of dynamically interacting integral membrane subunits of energy-coupling factor transporters. eLife. 9, e64389 (2020).
- Oropeza-Guzman, E., Ríos-Ramírez, M., Ruiz-Suárez, J. C. Leveraging the coffee ring effect for a defect-free electroformation of giant unilamellar vesicles. Langmuir. 35 (50), 16528-16535 (2019).
- Estes, D. J., Mayer, M. Electroformation of giant liposomes from spin-coated films of lipids. Colloids Surf B Biointerfaces. 42 (2), 115-123 (2005).

