Abschätzung der thermischen Schädigung durch robotergebohrte Kraniotomie bei der kranialen Fensterchirurgie bei Mäusen
Summary
Schädelfenster sind zu einer allgegenwärtig eingesetzten Operationstechnik geworden, um eine intravitale Bildgebung bei transgenen Mäusen zu ermöglichen. Dieses Protokoll beschreibt den Einsatz eines chirurgischen Roboters, der halbautomatische Knochenbohrungen von Schädelfenstern durchführt und dazu beitragen kann, die Variabilität von Chirurg zu Chirurg zu verringern und die Schädigung der thermischen Blut-Hirn-Schranke teilweise zu mildern.
Abstract
Die Schädelfensterchirurgie ermöglicht die Bildgebung von Hirngewebe bei lebenden Mäusen unter Verwendung von Multiphotonen oder anderen intravitalen Bildgebungsverfahren. Bei der Durchführung einer Kraniotomie von Hand kommt es jedoch häufig zu einer thermischen Schädigung des Hirngewebes, die von Natur aus von Chirurgie zu Operation variiert und von der Technik des einzelnen Chirurgen abhängen kann. Die Implementierung eines chirurgischen Roboters kann die Chirurgie standardisieren und zu einer Verringerung der mit der Operation verbundenen thermischen Schäden führen. In dieser Studie wurden drei Methoden des Roboterbohrens getestet, um thermische Schäden zu bewerten: horizontal, Punkt für Punkt und gepulst Punkt für Punkt. Beim Horizontalbohren wird ein kontinuierliches Bohrschema verwendet, während bei Punkt-für-Punkt-Bohrungen mehrere Löcher gebohrt werden, die das Schädelfenster umfassen. Die gepulste Punkt-für-Punkt-Bohrung fügt ein Bohrschema “2 s an, 2 s aus” hinzu, um eine Abkühlung zwischen den Bohrungen zu ermöglichen. Die Fluoreszenzbildgebung des intravenös injizierten Farbstoffs Evans Blue (EB) misst die Schädigung des Hirngewebes, während ein Thermoelement, das unter der Bohrstelle platziert ist, die thermische Schädigung misst. Die Thermoelementergebnisse deuten auf eine signifikante Abnahme der Temperaturänderung in der gepulsten Punkt-für-Punkt-Gruppe (6,90 °C ± 1,35 °C) im Vergleich zu den horizontalen (16,66 °C ± 2,08 °C) und Punkt-für-Punkt-Gruppen (18,69 °C ± 1,75 °C) hin. In ähnlicher Weise zeigte auch die gepulste Punkt-für-Punkt-Gruppe nach der kranialen Fensterbohrung im Vergleich zur horizontalen Methode eine signifikant geringere EB-Präsenz, was auf eine geringere Schädigung der Blutgefäße im Gehirn hinweist. Daher scheint ein gepulstes Punkt-für-Punkt-Bohrverfahren das optimale Schema zur Reduzierung thermischer Schäden zu sein. Ein Roboterbohrer ist ein nützliches Werkzeug, um das Training und die Variabilität zu minimieren und thermische Schäden zu reduzieren. Mit dem zunehmenden Einsatz von Multiphotonen-Bildgebung in Forschungslaboren ist es wichtig, die Genauigkeit und Reproduzierbarkeit der Ergebnisse zu verbessern. Die hier angesprochenen Methoden werden dazu beitragen, andere darüber zu informieren, wie diese chirurgischen Roboter besser eingesetzt werden können, um das Feld weiter voranzubringen.
Introduction
Schädelfenster sind in den Neurowissenschaften, der Neurotechnik und der Biologie allgegenwärtig geworden, um eine direkte Visualisierung und Bildgebung des Kortex bei lebenden Tieren zu ermöglichen 1,2,3,4,5,6,7,8,9,10,11 . Die leistungsstarke Kombination aus transgenen Mäusen und Multiphotonen-Bildgebung hat äußerst wertvolle Einblicke in die Schaltkreisaktivität und andere biologische Erkenntnisse im In-vivo-Gehirn geliefert 12,13,14,15,16,17,18. Miniaturmikroskope, die am Schädel montiert sind, haben diese Möglichkeiten weiter erweitert, um Aufnahmen bei wachen, sich frei bewegenden Tieren zu ermöglichen19. Der Prozess der Herstellung eines Schädelfensters erfordert ein Power-Drilling, um den Schädelknochen zu verdünnen oder vollständig zu entfernen, um Kraniotomien zu erzeugen, die groß genug sind, um ein transparentes Stück Glas über dem Kortex zu befestigen20. Polydimethylsiloxan (PDMS) und andere Polymere wurden ebenfalls als Schädelfenstermaterialien getestet 9,21. Letztendlich ist das ideale kraniale Fenster eines, das die normale endogene Aktivität darunter nicht verändert oder stört. Es ist jedoch allgemein anerkannt, dass das Bohren von Schädelfenstern das darunter liegende Gewebe verschlimmert, was zu einer Schädigung des Gehirns, einer Störung der Umgebung und einer Beeinträchtigung der Hirnhäute bis zu dem Punkt führt, an dem die Abbildungstiefe von Multiphotonen verdecktwird 22. Die daraus resultierende Neuroinflammation hat ein breites Spektrum an Auswirkungen, die von der Permeabilität der Blut-Hirn-Schranke (BHS) bis hin zur Aktivierung und Rekrutierung von Gliazellen um die Implantatstelle reichen23. Daher ist die Charakterisierung sichererer und reproduzierbarerer Schädelfensterbohrmethoden von entscheidender Bedeutung für eine gleichbleibende Bildqualität und die Reduzierung von Störfaktoren.
Während darauf geachtet wird, das Trauma des darunter liegenden Gewebes zu minimieren, hat das Bohren des Knochens das Potenzial, sowohl thermische als auch mechanische Störungen des Gehirns zu verursachen24,25. Ein mechanisches Trauma durch versehentliches Eindringen des Bohrers in die Dura kann darüber hinaus zu unterschiedlich starken kortikalen Verletzungen führen24. In einer Studie von Shoffstall et al.25 führte die Hitze des Knochenbohrens zu einer erhöhten BHS-Permeabilität, was durch das Vorhandensein des Farbstoffs Evans Blue (EB) im Hirnparenchymangezeigt wurde 25. Intravenös injizierter EB-Farbstoff bindet an zirkulierendes Albumin im Blutkreislauf und überquert daher normalerweise nicht in nennenswerten Konzentrationen eine gesunde BHS. Aus diesem Grund wird der EB-Farbstoff häufig als empfindlicher Marker für die BBB-Permeabilitätverwendet 26,27. Während ihre Studie den Einfluss der BHS-Permeabilität auf nachfolgende biologische Folgeerkrankungen nicht direkt gemessen hat, haben frühere Studien die BHS-Permeabilität mit einer erhöhten neuroinflammatorischen Reaktion auf chronisch implantierte Mikroelektroden und Veränderungen der motorischen Funktion korreliert28.
Abhängig von den Zielen der Studie kann das Ausmaß der thermischen und mechanischen Schädigung eine Quelle für experimentelle Fehler darstellen, die sich negativ auf die Genauigkeit und Reproduzierbarkeit der Studie auswirken. Es gibt Dutzende von zitierten Methoden zur Herstellung von Schädelfenstern, die jeweils unterschiedliche Bohrgeräte, Geschwindigkeiten, Techniken und Benutzer verwenden 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 berichteten, dass die beobachtete Variation der Erwärmungsergebnisse auf die Variabilität der vom Bohrer ausgeübten Kraft, der Vorschubgeschwindigkeit und des Anwendungswinkels zurückgeführt wurde, neben anderen Aspekten, die beim Bohren von Hand nicht kontrolliert werden können 25. Es wird angenommen, dass automatisierte Bohrsysteme und andere stereotaktische Geräte die Reproduzierbarkeit und die Konsistenz der Ergebnisse verbessern können, aber veröffentlichte Methodenstudien haben die Temperatur oder die BHS-Permeabilität als eines der Ergebnisse nicht rigoros bewertet. Daher besteht ein Bedarf an reproduzierbareren und konsequent angewandten Methoden zur Herstellung von Schädelfenstern sowie an Methoden, die rigoros angewendet werden, um die Auswirkungen von Schädelfensterbohrungen auf das darunter liegende Nervengewebe zu bewerten.
Der Fokus dieser Studie liegt auf der Ermittlung und Entwicklung konsistenter und sicherer Bohrmethoden für Schädelfenster. Die Größe der Kraniotomie bei der Installation von Schädelfenstern ist deutlich größer als bei Standard-Kraniotomien für mikroelektroden, die dem Gehirn implantiert werden. Solche Kraniotomien können nicht mit einem einzigen Bohrloch durchgeführt werden, wenn Standardgeräte verwendet werden, was zu einer größeren Variabilität der Technik zwischen den Chirurgen führt, wenn sie von Hand durchgeführt werden20. Chirurgische Bohrroboter wurden in der Praxis eingeführt, aber nicht weit verbreitet 1,6,29. Die Automatisierung des Bohrens bietet Kontrolle über Variablen, die zur beobachteten Variation von Versuch zu Versuch beitragen, was darauf hindeutet, dass der Einsatz der Geräte inter- und intrachirurgische Effekte reduzieren kann. Dies ist von besonderem Interesse, wenn man bedenkt, dass die größere Kraniotomie, die für die Platzierung des Schädelfensters erforderlich ist, zusätzlich schwierig ist. Während man davon ausgehen könnte, dass die Steuerung durch die Automatisierung des Bohrens klare Vorteile mit sich bringt, wurde die Implementierung dieser Geräte bisher kaum bewertet. Obwohl keine sichtbaren Läsionen beobachtet wurden5, ist der Test mit höherer Sensitivität mit EB erwünscht.
Hier wird die BHS-Permeabilität mit einem handelsüblichen chirurgischen Bohrroboter mit entsprechender Software gemessen, die die Programmierung stereotaktischer Koordinaten, die Kraniotomieplanung/-kartierung und eine Auswahl von Bohrstilen (“Punkt-für-Punkt” vs. “horizontal”) in Bezug auf den gerouteten Weg des Bohrmeißels ermöglicht. Zunächst werden acht “Seed”-Punkte gebohrt (Abbildung 1A), die das Schädelfenster umreißen. Von hier aus wird der Raum zwischen den Samen entweder mit der “Punkt-für-Punkt”- oder “horizontalen” Drillmethode ausgeschnitten. “Punkt-für-Punkt” führt vertikale Pilotlochschnitte durch (ähnlich wie bei einer CNC-Bohrmaschine), während “horizontal” horizontale Schnitte entlang des Umfangs des Schädelfensters ausführt, die das Loch umreißen (ähnlich wie bei einem CNC-Fräser). Das Ergebnis für beide Methoden ist ein Stück Schädel, das entfernt werden kann, um das Schädelfenster freizulegen. Um Schäden durch Bohrungen zu vermeiden, wird das Schädelfenster nicht physisch entfernt, um zusätzliche Schäden zu vermeiden. Eine Kombination aus EB-Farbstoff in Verbindung mit Fluoreszenzbildgebung wird verwendet, um die BHS-Permeabilität nach der Durchführung von Kraniotomien bei Mäusen zu messen, und ein eingesetztes Thermoelement wird verwendet, um die Temperatur der Gehirnoberfläche während des Bohrens direkt zu messen (Abbildung 1B, C). Frühere Beobachtungen deuteten darauf hin, dass das gepulste Ein- und Ausschalten des Bohrens mit Intervallen von 2 s ausreicht, um die Erwärmung des Bohrers25 zu verringern, und daher in den experimentellen Ansatz für den Operationsroboter einbezogen wird.
Ziel der vorliegenden Arbeit ist es, Methoden zur Beurteilung thermischer Schäden durch Kraniotomiebohrungen zu demonstrieren. Während die Methoden im Kontext des automatisierten Bohrens vorgestellt werden, können solche Methoden auch auf manuelle Bohrschemata angewendet werden. Diese Methoden können verwendet werden, um die Verwendung von Geräten und/oder Bohrschemata zu validieren, bevor sie als Standardverfahren übernommen werden.
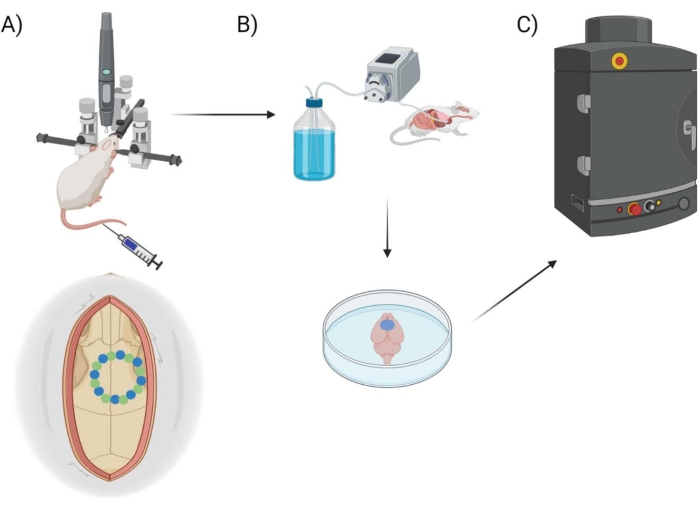
Abbildung 1: Schematische Darstellung der experimentellen Pipeline. Schematische Darstellung des Prozesses, dem die Tiere nach dem kranialen Fensterverfahren zur EB-Quantifizierung unterzogen wurden. (A) Schematischer Aufbau der Maus mit dem stereotaktischen Rahmen und dem chirurgischen Roboterbohrer. Ein Beispiel für ein kraniales Fenster ist über dem motorischen Kortex mit Startpunkten (grün) und Kantenpunkten (blau) dargestellt. (B) Der Perfusionsaufbau umfasst die Injektion von 1x phosphatgepufferter Kochsalzlösung (PBS) in das gesamte Tier, um Blut zu entfernen, gefolgt von der Extraktion des Gehirns. (C) Das Gehirn wird dann in die Kammer des EB-Fluoreszenzbildgebungssystems gegeben, um eine Fluoreszenzbildgebung mit dem Farbstoff Evans Blue durchzuführen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die Verwendung von EB-Farbstoff und Bildgebung ist einfach, schnell und nützlich, um Gefäßschäden im Gehirn für neue Methoden und Techniken zu bewerten. Unabhängig davon, ob ein chirurgischer Roboter verwendet wird oder um die Bestätigung von Methoden, die derzeit im Labor durchgeführt werden, ist es wichtig, chirurgische Methoden zu validieren, um die Auswirkungen experimenteller Behandlungen im Vergleich zu chirurgischen Auswirkungen zu isolieren und das Tierwohl zu verbessern. Ein Thermoelement-Setup ist auch …
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Diese Studie wurde zum Teil durch die Merit Review Awards GRANT12418820 (Capadona) und GRANTI01RX003420 (Shoffstall/Capadona) sowie den Research Career Scientist Award # GRANT12635707 (Capadona) des United States (US) Department of Veterans Affairs Rehabilitation Research and Development Service unterstützt. Darüber hinaus wurde diese Arbeit teilweise auch vom National Institute of Health, dem National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona) und dem National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona/Kirsch) unterstützt. Dieses Material basiert auf Arbeiten, die durch das Graduiertenforschungsstipendium der National Science Foundation unter der Fördernummer GRANT12635723 unterstützt wurden. Alle Meinungen, Erkenntnisse, Schlussfolgerungen oder Empfehlungen, die in diesem Material geäußert werden, sind die der Autoren und spiegeln nicht unbedingt die Ansichten der National Science Foundation wider.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Referencias
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neurociencias. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

