Avaliação do Dano Térmico da Craniotomia Robotizada para Cirurgia de Janela de Crânio em Camundongos
Summary
As janelas cranianas tornaram-se uma técnica cirúrgica onipresente para permitir imagens intravitais em camundongos transgênicos. Este protocolo descreve o uso de um robô cirúrgico que realiza perfuração óssea semi-automatizada de janelas cranianas e pode ajudar a reduzir a variabilidade cirurgião-cirurgião e mitigar parcialmente os danos da barreira térmica hematoencefálica.
Abstract
A cirurgia da janela craniana permite a obtenção de imagens de tecido cerebral em camundongos vivos com o uso de multifótons ou outras técnicas de imagem intravitais. No entanto, ao realizar qualquer craniotomia à mão, muitas vezes há dano térmico ao tecido cerebral, que é inerentemente variável de cirurgia para cirurgia e pode ser dependente da técnica individual do cirurgião. A implementação de um robô cirúrgico pode padronizar a cirurgia e levar a uma diminuição do dano térmico associado à cirurgia. Neste estudo, três métodos de perfuração robótica foram testados para avaliar o dano térmico: horizontal, ponto a ponto e pulsado ponto a ponto. A perfuração horizontal utiliza um esquema de perfuração contínua, enquanto a perfuração ponto a ponto faz vários furos que abrangem a janela craniana. O pulsado ponto a ponto adiciona um esquema de perfuração “2 s on, 2 s off” para permitir o resfriamento entre as perfurações. A imagem fluorescente do corante Azul de Evans (EB) injetado por via intravenosa mede os danos ao tecido cerebral, enquanto um termopar colocado sob o local de perfuração mede o dano térmico. Os resultados do termopar indicam uma diminuição significativa na mudança de temperatura no grupo pulsado ponto a ponto (6,90 °C ± 1,35 °C) em comparação com os grupos horizontal (16,66 °C ± 2,08 °C) e ponto a ponto (18,69 °C ± 1,75 °C). Da mesma forma, o grupo pulsado ponto a ponto também mostrou presença significativamente menor de EB após a perfuração da janela craniana em comparação com o método horizontal, indicando menos danos aos vasos sanguíneos no cérebro. Assim, um método de perfuração ponto a ponto pulsado parece ser o esquema ideal para reduzir o dano térmico. Uma furadeira robótica é uma ferramenta útil para ajudar a minimizar o treinamento, a variabilidade e reduzir os danos térmicos. Com a expansão do uso de imagens multifótons em laboratórios de pesquisa, é importante melhorar o rigor e a reprodutibilidade dos resultados. Os métodos abordados aqui ajudarão a informar outros sobre como usar melhor esses robôs cirúrgicos para avançar ainda mais no campo.
Introduction
As janelas cranianas tornaram-se utilizadas de forma ubíqua nos campos da neurociência, engenharia neural e biologia para permitir a visualização direta e a obtenção de imagens do córtex em animais vivos 1,2,3,4,5,6,7,8,9,10,11 . A poderosa combinação de camundongos transgênicos e imagens de múltiplos fótons forneceu informações extremamente valiosas sobre a atividade do circuito e outros conhecimentos biológicos no cérebro in vivo 12,13,14,15,16,17,18. Microscópios em miniatura montados no crânio ampliaram ainda mais essas capacidades para permitir gravações em animais acordados e em movimento livre19. O processo de criação de uma janela craniana requer perfurações elétricas para afinar ou remover completamente o osso craniano para produzir craniotomias grandes o suficiente para fixar um pedaço de vidro transparente sobre o córtex20. Polidimetilsiloxano (PDMS) e outros polímeros também têm sido testados como materiais de janela craniana 9,21. Em última análise, a janela craniana ideal é aquela que não altera ou interfere com a atividade endógena normal por baixo. No entanto, é comumente aceito que a perfuração da janela craniana agrava o tecido subjacente, levando a danos ao cérebro, ruptura do ambiente e afetando meninges a ponto de ocluir a profundidade de imagens multifótons22. A neuroinflamação resultante tem uma ampla gama de efeitos que vão desde a permeabilidade da barreira hematoencefálica (BHE), até a ativação e recrutamento de células gliais ao redor do local do implante23. Portanto, caracterizar métodos de perfuração de janela craniana mais seguros e reprodutíveis é crucial para uma qualidade de imagem consistente e redução dos fatores de confusão.
Enquanto se toma cuidado para minimizar o trauma no tecido subjacente, o ato de perfurar o osso tem o potencial de causar perturbações térmicas e mecânicas ao cérebro24,25. O trauma mecânico decorrente da penetração acidental da broca na dura-máter pode induzir graus variados de lesão cortical24. No estudo de Shoffstall et al.25, o calor da perfuração óssea resultou em aumento da permeabilidade à BHE, como indicado pela presença do corante Azul de Evans (EB) no parênquima cerebral 25. O corante EB, injetado por via intravenosa, liga-se à albumina circulante na corrente sanguínea e, portanto, normalmente não atravessa um BBB saudável em concentrações apreciáveis. Como resultado, o corante EB é comumente usado como um marcador sensível da permeabilidade à BHE26,27. Embora seu estudo não tenha medido diretamente o impacto da permeabilidade da BBB nas sequelas biológicas subsequentes em estudo, estudos anteriores correlacionaram a permeabilidade à BBB a uma resposta neuroinflamatória aumentada a microeletrodos implantados cronicamente e alterações na função motora28.
Dependendo dos objetivos do estudo, a magnitude dos danos térmicos e mecânicos pode contribuir como fonte de erro experimental, afetando negativamente o rigor e a reprodutibilidade do estudo. Existem dezenas de métodos citados para a confecção de janelas cranianas, cada um utilizando diferentes equipamentos de perfuração, velocidades, técnicas e usuários 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 relataram que a variação observada nos resultados de aquecimento foi atribuída à variabilidade na força aplicada, taxa de alimentação e ângulo de aplicação da broca, entre outros aspectos que não podem ser controlados durante a perfuraçãomanual25. Acredita-se que sistemas de perfuração automatizados e outros equipamentos estereotáxicos possam melhorar a reprodutibilidade e a consistência dos resultados, mas estudos de métodos publicados não avaliaram rigorosamente a temperatura ou a permeabilidade à BHE como um dos desfechos. Portanto, há necessidade de métodos mais reprodutíveis e consistentemente aplicados para produzir janelas cranianas, bem como métodos rigorosamente aplicados para avaliar o impacto da perfuração da janela craniana no tecido neural subjacente.
O foco deste estudo é determinar e desenvolver métodos de perfuração consistentes e seguros para janelas cranianas. O tamanho da craniotomia para instalação da janela craniana é significativamente maior do que as craniotomias padrão para microeletrodos implantados no cérebro. Tais craniotomias não podem ser completadas com um único orifício de broca quando se utiliza equipamento padrão, introduzindo maior variabilidade da técnica intercirurgião quando realizadasmanualmente20. Robôs de perfuração cirúrgica têm sido introduzidos no campo, mas ainda não têm sido amplamente adotados 1,6,29. A automação da perfuração oferece controle sobre as variáveis que contribuem para a variação experimental-a-experimental, sugerindo que o uso do equipamento pode reduzir os efeitos inter e intra-cirurgião. Isso é de particular interesse dada a dificuldade adicional da craniotomia maior necessária para a colocação da janela craniana. Embora se possa supor que haja benefícios claros para o controle proporcionado pela automação da perfuração, há pouca avaliação da implementação desses equipamentos. Embora lesões visíveis não tenham sidoobservadas5, o teste de maior sensibilidade com o uso da EB é desejado.
Aqui, a permeabilidade BBB é medida usando um robô de perfuração cirúrgica disponível comercialmente com software correspondente, que permite a programação de coordenadas estereotáxicas, planejamento/mapeamento de craniotomia e uma seleção de estilos de perfuração (“ponto-a-ponto” vs “horizontal”), referindo-se ao caminho roteado da broca. Inicialmente, são perfurados oito pontos de “semente” (Figura 1A), delineando a janela craniana. A partir daqui, o espaço entre as sementes é recortado usando o método de broca “ponto a ponto” ou “horizontal”. “Ponto a ponto” realiza cortes de furo piloto verticais (semelhante a uma prensa de perfuração CNC), enquanto “horizontal” realiza cortes horizontais ao longo da circunferência da janela craniana que delineia o furo (semelhante a um roteador CNC). O resultado para ambos os métodos é um pedaço de crânio que pode ser removido para revelar a janela craniana. Para isolar os danos da perfuração, a janela craniana não é removida fisicamente, de modo a evitar qualquer dano adicional. Uma combinação de corante EB acoplado a imagens fluorescentes é usada para medir a permeabilidade à BHB após a realização de craniotomias em camundongos, e um termopar inserido é usado para medir diretamente a temperatura da superfície cerebral durante a perfuração (Figura 1B,C). Observações anteriores indicaram que a perfuração pulsada liga/desliga com intervalos de 2 s foi suficiente para mitigar o aquecimento da broca25 e, portanto, está incorporada à abordagem experimental para o robô cirúrgico.
A intenção do trabalho apresentado é demonstrar métodos de avaliação de danos térmicos decorrentes da perfuração de craniotomias. Embora os métodos sejam apresentados no contexto da perfuração automatizada, tais métodos também podem ser aplicados a esquemas de perfuração manual. Esses métodos podem ser usados para validar o uso de equipamentos e/ou esquemas de perfuração antes de adotar como procedimento padrão.
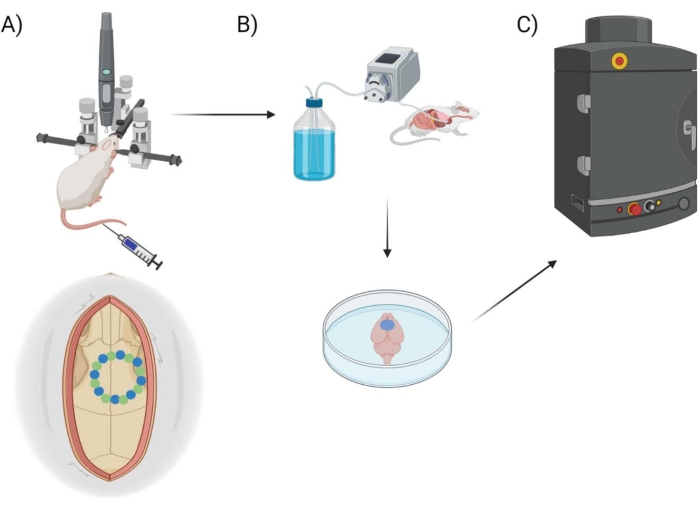
Figura 1: Esquema de pipeline experimental. Esquema demonstrando o processo a que os animais foram submetidos para quantificação da EB pós-janela craniana. (A) Configuração esquemática do mouse com a armação estereotáxica e broca robótica cirúrgica. Um exemplo de janela craniana é mostrada sobre o córtex motor com pontos de semente (verde) e pontos de borda (azul). (B) A configuração de perfusão inclui a injeção de 1x solução salina tamponada com fosfato (PBS) em todo o animal para remover qualquer sangue, seguida de extração do cérebro. (C) O cérebro é então colocado na câmara do sistema de imagem fluorescente EB para conduzir imagens fluorescentes no corante azul de Evans. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O uso de corante EB e imagens é simples, rápido e útil para avaliar o dano vascular no cérebro para novos métodos e técnicas. Seja usando um robô cirúrgico ou confirmando métodos atualmente feitos em laboratório, é importante validar métodos cirúrgicos para isolar os efeitos de tratamentos experimentais versus impacto cirúrgico e melhorar o bem-estar animal. Uma configuração de termopar também é útil na avaliação de métodos de perfuração para garantir que nenhum aquecimento ocorra. Sabe-se que o a…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Este estudo foi apoiado em parte pelos Prêmios de Revisão de Mérito GRANT12418820 (Capadona) e GRANTI01RX003420 (Shoffstall/Capadona), e pelo Prêmio de Cientista de Carreira de Pesquisa # GRANT12635707 (Capadona) do Serviço de Pesquisa e Desenvolvimento de Reabilitação do Departamento de Assuntos de Veteranos dos Estados Unidos (EUA). Além disso, este trabalho também foi apoiado em parte pelo National Institute of Health, pelo National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona) e pelo National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona/Kirsch). Este material é baseado em trabalho apoiado pela National Science Foundation Graduate Research Fellowship sob o número GRANT AWARD12635723. Quaisquer opiniões, descobertas e conclusões ou recomendações expressas neste material são dos autores e não refletem necessariamente as opiniões da National Science Foundation.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Referencias
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neurociencias. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

