הערכת נזק תרמי מקרניוטומיה שנקדחה על ידי רובוט לניתוח חלון גולגולת בעכברים
Summary
חלונות גולגולת הפכו לטכניקה כירורגית המיושמת בכל מקום כדי לאפשר הדמיה תוך חיונית בעכברים טרנסגניים. פרוטוקול זה מתאר את השימוש ברובוט כירורגי המבצע קידוח עצם חצי אוטומטי של חלונות גולגולת ויכול לסייע בהפחתת השונות בין מנתח למנתח ולהפחית חלקית את הנזק התרמי למחסום הדם-מוח.
Abstract
ניתוח חלון גולגולת מאפשר הדמיה של רקמת המוח בעכברים חיים באמצעות מולטיפוטון או טכניקות הדמיה תוך חיוניות אחרות. עם זאת, בעת ביצוע כל craniotomy ביד, יש לעתים קרובות נזק תרמי לרקמת המוח, אשר משתנה מטבעו ניתוח לניתוח עשוי להיות תלוי בטכניקה מנתח בודד. הטמעת רובוט כירורגי יכולה לתקנן את הניתוח ולהוביל לירידה בנזק התרמי הקשור לניתוח. במחקר זה נבדקו שלוש שיטות של קידוח רובוטי להערכת נזק תרמי: אופקי, נקודה אחר נקודה ופעימות נקודה אחר נקודה. קידוח אופקי משתמש בסכמת קידוח רציפה, בעוד נקודה אחר נקודה קודח מספר חורים המקיפים את חלון הגולגולת. פעימות נקודה אחר נקודה מוסיפות סכימת קידוח “2 שניות על, 2 שניות כבויות” כדי לאפשר קירור בין הקידוחים. הדמיה פלואורסצנטית של צבע כחול אוונס (EB) המוזרק לווריד מודדת נזק לרקמת המוח, בעוד זוג תרמי הממוקם מתחת לאתר הקידוח מודד נזק תרמי. תוצאות זוג תרמי מצביעות על ירידה משמעותית בשינוי הטמפרטורה בקבוצת הפועמים נקודה אחר נקודה (6.90 ° C ± 1.35 ° C) בהשוואה לקבוצה האופקית (16.66 ° C ± 2.08 ° C) ונקודה אחר נקודה (18.69 ° C ± 1.75 ° C). באופן דומה, קבוצת הפולסים נקודה אחר נקודה גם הראתה נוכחות EB נמוכה משמעותית לאחר קידוח חלון גולגולתי בהשוואה לשיטה האופקית, מה שמצביע על פחות נזק לכלי הדם במוח. לפיכך, שיטת קידוח פועמת נקודה אחר נקודה נראית כתוכנית האופטימלית להפחתת נזק תרמי. מקדחה רובוטית היא כלי שימושי המסייע למזער אימונים, שונות ולהפחית נזק תרמי. עם השימוש המתרחב בדימות מולטיפוטונים במעבדות מחקר, חשוב לשפר את הקשיחות ואת יכולת השחזור של התוצאות. השיטות המטופלות כאן יסייעו ליידע אחרים כיצד להשתמש טוב יותר ברובוטים כירורגיים אלה כדי לקדם עוד יותר את התחום.
Introduction
חלונות גולגולת נמצאים בשימוש נפוץ בכל תחומי מדעי המוח, הנדסה עצבית וביולוגיה כדי לאפשר הדמיה ישירה והדמיה של קליפת המוח בבעלי חיים 1,2,3,4,5,6,7,8,9,10,11 . השילוב רב העוצמה של עכברים טרנסגניים והדמיית מולטיפוטונים סיפק תובנות בעלות ערך רב על פעילות המעגלים ותובנות ביולוגיות אחרות במוח in vivo 12,13,14,15,16,17,18. מיקרוסקופים זעירים המותקנים על הגולגולת הרחיבו יכולות אלה עוד יותר כדי לאפשר הקלטות בבעלי חיים ערים הנעים בחופשיות19. תהליך יצירת חלון גולגולתי דורש קידוח כוח כדי לדלל או להסיר לחלוטין את עצם הגולגולת כדי לייצר קרניוטומיות גדולות מספיק כדי להבטיח חתיכת זכוכית שקופה מעל קליפת המוח20. פולידימתילסילוקסאן (PDMS) ופולימרים אחרים נבדקו גם כחומרי חלון גולגולתי 9,21. בסופו של דבר, חלון הגולגולת האידיאלי הוא חלון שאינו משנה או מפריע לפעילות אנדוגנית נורמלית מתחת. עם זאת, מקובל כי קידוח חלונות גולגולת מחמיר את הרקמה הבסיסית, מוביל לנזק למוח, הפרעה לסביבה והשפעה על קרומי המוח עד כדי הסתרת עומק הדמיה מולטיפוטון22. לדלקת העצבית המתקבלת יש מגוון רחב של השפעות החל מחדירות מחסום הדם-מוח (BBB), ועד הפעלה וגיוס של תאי גלייה סביב אתר השתל23. לכן, אפיון שיטות קידוח חלון גולגולת בטוחות וניתנות לשחזור הוא חיוני לאיכות הדמיה עקבית ולהפחתת גורמים מבלבלים.
בעוד שננקטת זהירות כדי למזער את הטראומה לרקמה הבסיסית, לפעולת קידוח העצם יש פוטנציאל לגרום להפרעות תרמיות ומכניות למוח24,25. טראומה מכנית מחדירת מקדח בשוגג לתוך הדורה עלולה לגרום בדרגות שונות של פגיעה בקליפת המוח24. במחקר שנערך על ידי Shoffstall et al.25, החום מקידוח עצם הביא לחדירות מוגברת של BBB, כפי שצוין על ידי נוכחות של צבע כחול אוונס (EB) בפרנכימה במוח 25. צבע EB, המוזרק לווריד, נקשר לאלבומין במחזור הדם ולכן בדרך כלל אינו חוצה BBB בריא בריכוזים ניכרים. כתוצאה מכך, צבע EB משמש בדרך כלל כסמן רגיש של חדירות BBB26,27. בעוד המחקר שלהם לא מדד ישירות את ההשפעה של חדירות BBB על sequelae ביולוגי לאחר מכן תחת מחקר, מחקרים קודמים מצאו קשר חדירות BBB לתגובה נוירו-דלקתית מוגברת למיקרואלקטרודות מושתלות כרוניות ושינויים בתפקוד המוטורי28.
בהתאם למטרות המחקר, עוצמת הנזק התרמי והמכני עשויה לתרום מקור לטעות ניסויית, ולהשפיע לרעה על הקשיחות והשחזור של המחקר. ישנן עשרות שיטות מצוטטות לייצור חלונות גולגולת, כל אחת באמצעות ציוד קידוח שונה, מהירויות, טכניקות, ומשתמשים 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 דיווחו כי השונות שנצפתה בתוצאות החימום יוחסה לשונות בכוח המופעל של הקידוח, בקצב ההזנה ובזווית היישום שלו, בין היבטים אחרים שלא ניתן לשלוט בהם בעת קידוח ביד 25. קיימת אמונה כי מערכות קידוח אוטומטיות וציוד סטריאוטקסי אחר יכולים לשפר את יכולת השחזור ואת עקביות התוצאה, אך מחקרי שיטה שפורסמו לא העריכו בקפדנות טמפרטורה או חדירות BBB כאחת התוצאות. לכן, יש צורך בשיטות ניתנות יותר לשחזור ומיושמות באופן עקבי לייצור חלונות גולגולת, כמו גם שיטות המיושמות בקפדנות כדי להעריך את ההשפעה של קידוח חלון גולגולתי על רקמה עצבית בסיסית.
מטרת מחקר זה היא לקבוע ולפתח שיטות קידוח עקביות ובטוחות לחלונות גולגולת. גודל הקרניוטומיה להתקנת חלון גולגולתי גדול משמעותית מקרניוטומיות סטנדרטיות עבור מיקרואלקטרודות מושתלות במוח. קרניוטומיות כאלה לא ניתן להשלים עם חור בור יחיד בעת שימוש בציוד סטנדרטי, ובכך להציג יותר שונות טכניקה בין מנתחים כאשר מבוצע על ידי יד20. רובוטים לקידוח כירורגי הוכנסו לתחום, אך לא אומצו באופן נרחב 1,6,29. אוטומציה של קידוחים מציעה שליטה על משתנים התורמים לשונות שנצפתה מניסוי לניסוי, מה שמרמז על כך שהשימוש בציוד יכול להפחית את ההשפעות הבין-מנתחות והפנים-מנתחות. זה מעניין במיוחד בהתחשב בקושי הנוסף של קרניוטומיה גדולה יותר הדרושה למיקום חלון גולגולתי. בעוד שניתן להניח שיש יתרונות ברורים לבקרה המסופקת על ידי אוטומציה של הקידוחים, הייתה הערכה מועטה של יישום ציוד זה. למרות שנגעים גלויים לא נצפו5, בדיקת רגישות גבוהה יותר באמצעות EB רצויה.
כאן, חדירות BBB נמדדת באמצעות רובוט קידוח כירורגי זמין מסחרית עם תוכנה מתאימה, המאפשר תכנות של קואורדינטות סטריאוטקסיות, תכנון/מיפוי קרניוטומיה, ומבחר סגנונות קידוח (“נקודה אחר נקודה” לעומת “אופקי”), המתייחסים לנתיב המנותב של מקדח. בתחילה קודחים שמונה נקודות “זרע” (איור 1A), המתארות את חלון הגולגולת. מכאן, הרווח בין הזרעים נחתך בשיטת “נקודה אחר נקודה” או “אופקית”. “נקודה אחר נקודה” מבצע חיתוכים אנכיים של חור טייס (בדומה למקדח CNC), ואילו “אופקי” מבצע חיתוכים אופקיים לאורך היקף חלון הגולגולת המתווה את החור (בדומה לנתב CNC). התוצאה עבור שתי השיטות היא חתיכת גולגולת שניתן להסיר כדי לחשוף את חלון הגולגולת. כדי לבודד נזק מקידוח, חלון הגולגולת אינו מוסר פיזית, כדי למנוע נזק נוסף. שילוב של צבע EB בשילוב עם הדמיה פלואורסצנטית משמש למדידת חדירות BBB לאחר ביצוע קרניוטומיות בעכברים, וזוג תרמי שהוחדר משמש למדידה ישירה של הטמפרטורה של פני השטח במוח במהלך הקידוח (איור 1B,C). תצפיות קודמות הצביעו על כך שקידוח פועם במרווחים של 2 שניות הספיק כדי להפחית את חימום הקידוח25, ולכן הוא משולב בגישה הניסויית עבור הרובוט הכירורגי.
מטרת העבודה המוצגת היא להדגים שיטות להערכת נזק תרמי מקידוח קרניוטומיה. בעוד שהשיטות מוצגות בהקשר של קידוח אוטומטי, ניתן ליישם שיטות כאלה גם על תוכניות קידוח ידניות. ניתן להשתמש בשיטות אלה כדי לאמת את השימוש בציוד ו / או תוכניות קידוח לפני אימוץ כהליך סטנדרטי.
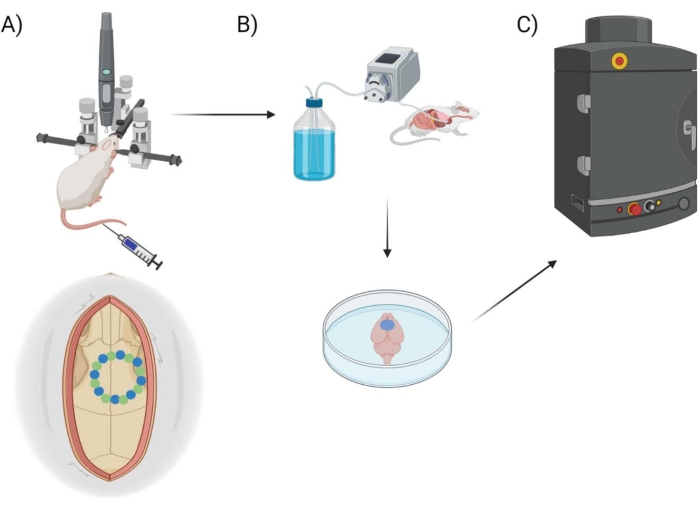
איור 1: סכמת צינור ניסיוני. הדגמה סכמטית של התהליך שבעלי חיים עברו לצורך כימות EB לאחר הליך חלון גולגולתי. (A) התקנה סכמטית של העכבר עם המסגרת הסטריאוטקסית ומקדח הרובוט הכירורגי. חלון גולגולתי לדוגמה מוצג מעל קליפת המוח המוטורית עם נקודות זרע (ירוק) ונקודות קצה (כחול). (B) מערך הזילוח כולל הזרקת 1x פוספט חוצץ מלוחים (PBS) ברחבי החיה כדי להסיר כל דם, ולאחר מכן מיצוי של המוח. (C) המוח מוכנס לאחר מכן לתא מערכת הדימות הפלואורסצנטי EB כדי לבצע הדמיה פלואורסצנטית על הצבע הכחול של אוונס. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
השימוש בצבע EB והדמיה הוא פשוט, מהיר ושימושי להערכת נזק לכלי הדם במוח עבור שיטות וטכניקות חדשות. בין אם באמצעות רובוט כירורגי ובין אם מדובר בשיטות אישור הנעשות כיום במעבדה, חשוב לתקף שיטות כירורגיות כדי לבודד את ההשפעות של טיפולים ניסיוניים לעומת השפעה כירורגית ולשפר את רווחת בעלי החיים. ה?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
מחקר זה נתמך בחלקו על ידי Merit Review Awards GRANT12418820 (Capadona) ו- GRANTI01RX003420 (Shoffstall/Capadona), ופרס מדען קריירת מחקר # GRANT12635707 (קפדונה) משירות המחקר והפיתוח השיקומי של המחלקה לענייני חיילים משוחררים בארצות הברית (ארה”ב). בנוסף, עבודה זו נתמכה בחלקה גם על ידי המכון הלאומי לבריאות, המכון הלאומי להפרעות נוירולוגיות ושבץ מוחי GRANT12635723 (קפדונה), והמכון הלאומי לדימות ביו-רפואי וביו-הנדסה, T32EB004314, (קפדונה / קירש). חומר זה מבוסס על עבודה הנתמכת על ידי מלגת המחקר לתארים מתקדמים של הקרן הלאומית למדע במסגרת מענק מס’ GRANT12635723. כל דעה, ממצאים, מסקנות או המלצות המובעות בחומר זה הן של המחברים/ות ואינן משקפות בהכרח את השקפותיה של הקרן הלאומית למדע.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Referencias
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neurociencias. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

