Оценка термических повреждений от роботизированной краниотомии для хирургии черепного окна у мышей
Summary
Черепные окна стали повсеместно применяемым хирургическим методом, позволяющим проводить прижизненную визуализацию у трансгенных мышей. Этот протокол описывает использование хирургического робота, который выполняет полуавтоматическое сверление костей черепных окон и может помочь уменьшить вариабельность от хирурга к хирургу и частично смягчить термическое повреждение гематоэнцефалического барьера.
Abstract
Хирургия черепного окна позволяет визуализировать мозговую ткань у живых мышей с использованием многофотонных или других методов прижизненной визуализации. Однако при выполнении любой трепанации черепа вручную часто происходит термическое повреждение ткани головного мозга, которое по своей сути варьируется от операции к операции и может зависеть от индивидуальной техники хирурга. Внедрение хирургического робота может стандартизировать хирургическое вмешательство и привести к уменьшению термических повреждений, связанных с хирургическим вмешательством. В этом исследовании были протестированы три метода роботизированного бурения для оценки теплового повреждения: горизонтальный, точечный и импульсный точечно. Горизонтальное бурение использует схему непрерывного сверления, в то время как точечное сверление нескольких отверстий, охватывающих краниальное окно. Импульсная точка за точкой добавляет схему бурения «2 с вкл., 2 с выкл.» для обеспечения охлаждения между бурениями. Флуоресцентная визуализация красителя Evans Blue (EB), вводимого внутривенно, измеряет повреждение тканей головного мозга, в то время как термопара, помещенная под место сверления, измеряет термическое повреждение. Результаты термопар указывают на значительное снижение изменения температуры в импульсной двухточечной (6,90 °C ± 1,35 °C) группе по сравнению с горизонтальной (16,66 °C ± 2,08 °C) и точечной (18,69 °C ± 1,75 °C) группами. Аналогичным образом, импульсная точечная группа также показала значительно меньшее присутствие БЭ после сверления черепного окна по сравнению с горизонтальным методом, что указывает на меньшее повреждение кровеносных сосудов в головном мозге. Таким образом, импульсный точечный метод бурения представляется оптимальной схемой снижения термического повреждения. Роботизированная дрель — полезный инструмент, помогающий свести к минимуму обучение, вариативность и уменьшить термические повреждения. С расширением использования многофотонной визуализации в исследовательских лабораториях важно повысить строгость и воспроизводимость результатов. Методы, рассмотренные здесь, помогут проинформировать других о том, как лучше использовать этих хирургических роботов для дальнейшего продвижения в этой области.
Introduction
Черепные окна стали повсеместно использоваться в областях неврологии, нейронной инженерии и биологии, чтобы обеспечить прямую визуализацию и визуализацию коры головного мозга у живых животных 1,2,3,4,5,6,7,8,9,10,11 . Мощная комбинация трансгенных мышей и многофотонной визуализации дала чрезвычайно ценную информацию об активности цепи и других биологических знаниях в мозге in vivo 12,13,14,15,16,17,18. Миниатюрные микроскопы, установленные на черепе, еще больше расширили эти возможности, чтобы обеспечить запись бодрствующих, свободно движущихся животных19. Процесс создания черепного окна требует силового сверления для истончения или полного удаления черепной кости для получения достаточно больших краниотомий, чтобы закрепить прозрачный кусок стекла над корой20. Полидиметилсилоксан (ПДМС) и другие полимеры также были испытаны в качестве материалов для черепных окон 9,21. В конечном счете, идеальное черепное окно – это то, которое не изменяет и не мешает нормальной эндогенной активности под ним. Тем не менее, общепризнано, что сверление черепного окна усугубляет подлежащую ткань, что приводит к повреждению мозга, нарушению окружающей среды и влиянию на мозговые оболочки до такой степени, что закупоривает многофотонную визуализацию глубиной22. Возникающее в результате нейровоспаление имеет широкий спектр эффектов, начиная от проницаемости гематоэнцефалического барьера (ГЭБ) и заканчивая активацией и рекрутированием глиальных клеток вокруг местаимплантации 23. Таким образом, определение более безопасных и воспроизводимых методов сверления черепных окон имеет решающее значение для стабильного качества визуализации и снижения смешанных факторов.
В то время как принимаются меры для минимизации травмы подлежащих тканей, акт сверления кости может вызвать как термические, так и механические возмущения мозга24,25. Механическая травма в результате случайного проникновения сверла в твердую мозговую оболочку может дополнительно вызвать повреждение коры головного мозга различной степени24. В исследовании, проведенном Shoffstall et al.25, тепло от сверления костей приводило к повышенной проницаемости ГЭБ, о чем свидетельствует присутствие красителя Evans Blue (EB) в паренхиме головного мозга 25. Краситель БЭ, вводимый внутривенно, связывается с циркулирующим альбумином в кровотоке и, следовательно, обычно не проникает через здоровый ГЭБ в заметных концентрациях. В результате краситель EB обычно используется в качестве чувствительного маркера проницаемости ГЭБ26,27. Хотя их исследование напрямую не измеряло влияние проницаемости ГЭБ на последующие биологические последствия, предыдущие исследования коррелировали проницаемость ГЭБ с повышенной нейровоспалительной реакцией на хронически имплантированные микроэлектроды и изменениями двигательной функции28.
В зависимости от целей исследования, величина термических и механических повреждений может способствовать источнику экспериментальной ошибки, отрицательно влияя на строгость и воспроизводимость исследования. Существуют десятки цитируемых методов изготовления черепных окон, каждый из которых использует различное буровое оборудование, скорости, методы и пользователей 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 сообщили, что наблюдаемые изменения в результатах нагрева были связаны с изменчивостью приложенной силы бура, скорости подачи и угла применения, а также с другими аспектами, которые не могут контролироваться при бурении вручную 25. Существует мнение, что автоматизированные системы бурения и другое стереотаксическое оборудование могут улучшить воспроизводимость и согласованность результатов, но опубликованные исследования методов не проводили строгой оценки температуры или проницаемости ГЭБ в качестве одного из результатов. Таким образом, существует потребность в более воспроизводимых и последовательно применяемых методах изготовления черепных окон, а также в методах, строго применяемых для оценки воздействия сверления черепных окон на подлежащую нервную ткань.
Основное внимание в этом исследовании уделяется определению и разработке последовательных и безопасных методов бурения черепных окон. Размер трепанации черепа для установки черепного окна значительно больше, чем у стандартной трепанации для имплантированных в мозг микроэлектродов. Такая трепанация черепа не может быть выполнена с помощью одного отверстия для заусенцев при использовании стандартного оборудования, тем самым привнося большую вариабельность техники между хирургами при выполнении рукой20. Хирургические буровые роботы были введены в поле, но не получили широкого распространения 1,6,29. Автоматизация бурения обеспечивает контроль над переменными, способствующими наблюдаемым изменениям от испытания к испытанию, предполагая, что использование оборудования может уменьшить меж- и внутрихирургические эффекты. Это представляет особый интерес, учитывая дополнительную сложность большой трепанации черепа, необходимой для установки черепного окна. Хотя можно было бы предположить, что автоматизация бурения дает очевидные преимущества для контроля, было мало оценок внедрения этого оборудования. Хотя видимых поражений не наблюдалось5, желателен тест с более высокой чувствительностью с использованием БЭ.
Здесь проницаемость ГЭБ измеряется с помощью коммерчески доступного хирургического сверлильного робота с соответствующим программным обеспечением, которое позволяет программировать стереотаксические координаты, планировать/картировать трепанацию черепа и выбирать стили бурения («точка за точкой» и «горизонтально»), ссылаясь на маршрутизированную траекторию бурового долота. Вначале просверливаются восемь «семенных» точек (рис. 1А), очерчивающих краниальное окно. Отсюда пространство между семенами вырезается с помощью «точечного» или «горизонтального» метода сверления. «Точка за точкой» выполняет вертикальные пропилы пилотных отверстий (аналогично сверлильному станку с ЧПУ), а «горизонтальный» выполняет горизонтальные разрезы по окружности черепного окна, которые очерчивают отверстие (аналогично фрезерному станку с ЧПУ). Результатом обоих методов является кусок черепа, который можно удалить, чтобы открыть черепное окно. Чтобы изолировать повреждения от сверления, черепное окно физически не удаляется, чтобы избежать каких-либо дополнительных повреждений. Комбинация красителя EB в сочетании с флуоресцентной визуализацией используется для измерения проницаемости ГЭБ после выполнения краниотомии у мышей, а вставленная термопара используется для непосредственного измерения температуры поверхности мозга во время сверления (рис. 1B, C). Предыдущие наблюдения показали, что импульсное включение/выключение бурения с интервалом 2 с было достаточным для смягчения нагревасверла 25 и, следовательно, включено в экспериментальный подход для хирургического робота.
Целью представленной работы является демонстрация методов оценки термических повреждений от трепанации черепа. Хотя методы представлены в контексте автоматизированного бурения, такие методы могут быть применены и к схемам ручного бурения. Эти методы могут быть использованы для проверки использования оборудования и/или схем бурения перед принятием в качестве стандартной процедуры.
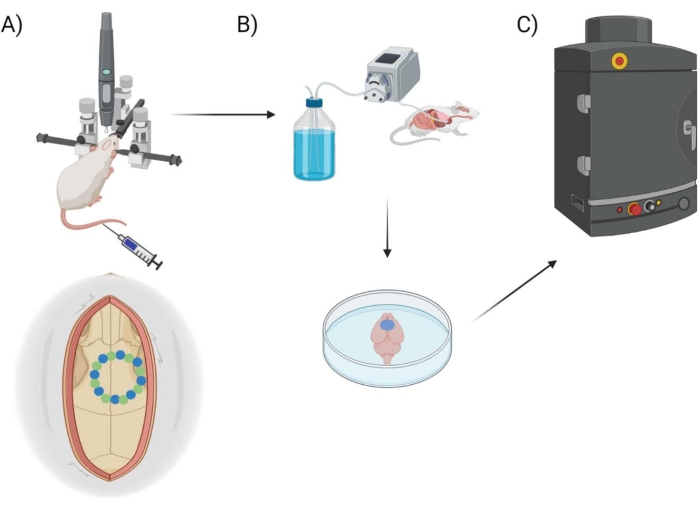
Рисунок 1: Схема экспериментального трубопровода. Схема, демонстрирующая процесс, которому подверглись животные для количественной оценки БЭ после процедуры черепного окна. (A) Схематическая установка мыши со стереотаксической рамой и дрелью хирургического робота. Пример черепного окна показан над моторной корой с начальными точками (зеленый) и краевыми точками (синий). (B) Перфузионная установка включает в себя инъекцию 1x фосфатного буферного физиологического раствора (PBS) по всему животному для удаления крови с последующим извлечением мозга. (C) Затем мозг помещают в камеру флуоресцентной системы визуализации EB для проведения флуоресцентной визуализации на красителе Evans Blue. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Использование красителя EB и визуализации является простым, быстрым и полезным для оценки сосудистых повреждений в головном мозге для новых методов и техник. Независимо от того, используете ли вы хирургического робота или подтверждаете методы, которые в настоящее время проводятся в ла?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Это исследование было частично поддержано наградами за заслуги GRANT12418820 (Кападона) и GRANTI01RX003420 (Шоффстолл/Кападона), а также премией за карьеру ученого-исследователя # GRANT12635707 (Кападона) от Службы исследований и разработок в области реабилитации Министерства по делам ветеранов США (США). Кроме того, эта работа также была частично поддержана Национальным институтом здравоохранения, Национальным институтом неврологических расстройств и инсульта GRANT12635723 (Кападона) и Национальным институтом биомедицинской визуализации и биоинженерии, T32EB004314 (Capadona/Kirsch). Этот материал основан на работе, поддержанной стипендией Национального научного фонда для аспирантов в рамках гранта No GRANT12635723. Любые мнения, выводы, выводы или рекомендации, выраженные в этом материале, принадлежат авторам и не обязательно отражают точку зрения Национального научного фонда.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Referencias
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neurociencias. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

