Imagerie en direct des premiers progéniteurs cardiaques dans l’embryon de souris
Summary
Nous présentons un protocole détaillé pour la culture et l’imagerie d’embryons de souris qui permet l’imagerie 3D + temps des cellules progénitrices cardiaques. Cette boîte à outils vidéo aborde les compétences clés requises pour réussir l’imagerie en direct autrement difficile à acquérir à partir de publications textuelles.
Abstract
Les premières étapes du développement cardiaque impliquent des changements drastiques dans le comportement et la différenciation cellulaire. Alors que l’analyse d’embryons fixes permet d’étudier en détail des stades de développement spécifiques dans un instantané fixe, l’imagerie en direct capture des événements morphogénétiques dynamiques, tels que la migration cellulaire, les changements de forme et la différenciation, en imageant l’embryon au fur et à mesure de son développement. Cela complète l’analyse fixe et élargit la compréhension de la façon dont les organes se développent au cours de l’embryogenèse. Malgré ses avantages, l’imagerie en direct est rarement utilisée dans les modèles murins en raison de ses défis techniques. Les embryons précoces de souris sont sensibles lorsqu’ils sont cultivés ex vivo et nécessitent une manipulation efficace. Pour faciliter une utilisation plus large de l’imagerie en direct dans la recherche sur le développement de la souris, cet article présente un protocole détaillé pour la microscopie vivante à deux photons qui permet l’acquisition à long terme dans les embryons de souris. En plus du protocole, des conseils sont fournis sur la manipulation des embryons et l’optimisation de la culture. Cela aidera à comprendre les événements clés de l’organogenèse précoce de la souris, améliorant ainsi la compréhension de la biologie des progéniteurs cardiovasculaires.
Introduction
Le cœur se forme tôt au cours de l’embryogenèse pour commencer à pomper les nutriments vers l’embryon entier, tandis qu’il continue à se développer1. Chez les embryons de souris, un jour et demi après le début de la gastrulation, un organe cardiaque rudimentaire s’assemble au pôle antérieur 2,3. Au stade Early Streak (ES), les progéniteurs cardiaques de l’épiblaste pénètrent à travers la traînée primitive jusqu’à la couche mésodermique naissante 4,5,6 et commencent à migrer vers le pôle antérieur, où ils se différencient pour former le tube cardiaque primitif. Tout au long de ce processus, les premiers progéniteurs cardiaques subissent des réarrangements cellulaires, des transformations de forme et une différenciation, en plus de la migration7 (Figure 1).
Les premiers progéniteurs cardiaques attirent les chercheurs depuis près d’un siècle en raison de leur capacité remarquable à différencier et à construire un organe fonctionnel simultanément. Au cours des deux dernières décennies, l’analyse clonale et les modèles d’élimination conditionnelle ont montré que le développement cardiaque précoce implique des sources cellulaires distinctes dans un processus hautement dynamique 8,9,10. Cependant, la structure 3D du tube cardiaque primitif et la nature dynamique de sa morphogenèse le rendent difficile à étudier (Figure 1), et nous sommes loin d’en comprendre toute la complexité11.
Pour étudier ces processus cellulaires dynamiques, les méthodes d’imagerie en direct offrent maintenant un détail sans précédent 7,12,13,14. Dans le modèle murin, les approches en direct ont été essentielles pour interroger les sujets de développement qui sont difficiles à aborder par l’analyse statique 7,13,15. Alors que la culture ex vivo à long terme et les configurations de microscope robustes progressent rapidement16,17, peu de chercheurs ont l’expertise nécessaire pour imager avec succès des embryons vivants. Bien que les publications papier fournissent suffisamment de détails techniques pour reproduire des expériences d’imagerie en direct, certaines compétences et astuces sont difficiles à saisir sans exemples visuels ou assistance entre pairs. Pour accélérer ce processus d’apprentissage et étendre l’utilisation de l’imagerie en direct parmi les laboratoires, nous avons assemblé un protocole vidéo (Figure 2) qui rassemble les compétences nécessaires pour effectuer une imagerie en direct sur des embryons de souris en phase gastrulée.
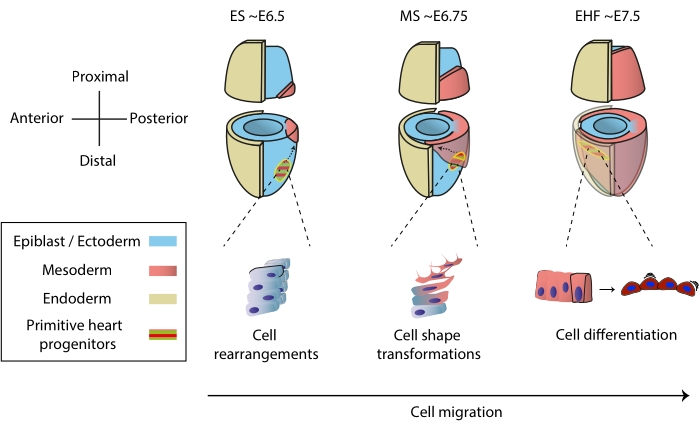
Figure 1 : Différenciation précoce des cellules progénitrices cardiaques dans l’embryon de souris depuis le début de la gastrulation jusqu’au stade précédant la formation primitive du tube cardiaque. Les cellules progénitrices cardiaques pénètrent dans le mésoderme peu après le début de la gastrulation, migrant vers le côté opposé de l’embryon. Le stade morphologique et le stade embryonnaire du jour (E) sont écrits au-dessus des diagrammes. Les flèches pointillées représentent la trajectoire de migration des progéniteurs primitifs du tube cardiaque pendant la gastrulation. Ce chiffre a été adapté de11. Abréviations : ES = Early Streak; MS = Traînée moyenne; EHF = pli précoce de la tête. Veuillez cliquer ici pour voir une version agrandie de cette figure.
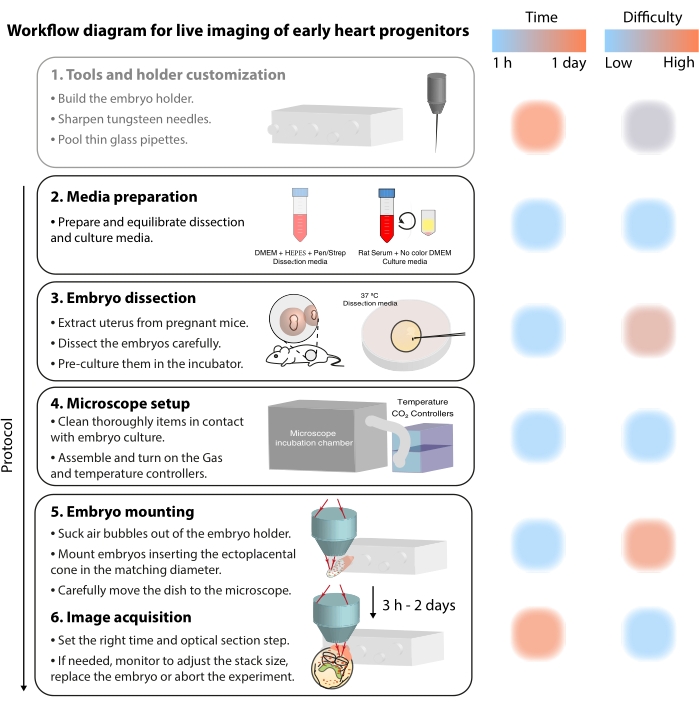
Figure 2 : Diagramme de flux de travail pour l’imagerie en direct des premiers progéniteurs cardiaques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Les premiers progéniteurs cardiaques s’organisent dans un tube cardiaque primitif qui commence à battre alors qu’il est encore en formation. Comprendre comment ce processus se déroule est essentiel pour identifier le large spectre des malformations cardiaques congénitales à des événements morphogénétiques spécifiques. Pour cela, l’imagerie en direct offre la possibilité d’étudier le développement embryonnaire normal et défectueux avec une résolution temporelle accrue. Ceci est particulièrement uti…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient le Dr Kenzo Ivanovitch pour ses travaux antérieurs sur cette méthode et le groupe du Dr Shigenori Nonaka (National Institutes of Natural Sciences, Japon) pour avoir fourni l’expertise initiale sur le montage d’embryons. Cette étude a été soutenue par la subvention PGC2018-096486-B-I00 du ministère espagnol de la Ciencia e Innovación et la subvention H2020-MSCA-ITN-2016-722427 du programme Horizon 2020 de l’UE à MT et la subvention 1380918 du programme opérationnel FEDER Andalucía 2014-2020 à JND. MS a été soutenu par une bourse de doctorat de la Fondation La Caixa (LCF / BQ / DE18 / 11670014) et la bourse de voyage de la Compagnie des biologistes (DEVTF181145). Le CNIC est soutenu par le ministère espagnol des Sciences et la Fondation ProCNIC.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
Referencias
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

