Живая визуализация ранних сердечных предшественников в эмбрионе мыши
Summary
Мы представляем подробный протокол культивирования и визуализации эмбрионов мышей, который позволяет выполнять 3D+ временную визуализацию клеток-предшественников сердца. Этот видеоинструментарий посвящен ключевым навыкам, необходимым для успешной визуализации в реальном времени, которые в противном случае трудно получить из текстовых публикаций.
Abstract
Первые шаги развития сердца подразумевают резкие изменения в поведении и дифференцировке клеток. В то время как анализ фиксированных эмбрионов позволяет детально изучить конкретные стадии развития на неподвижном снимке, живая визуализация фиксирует динамические морфогенетические события, такие как миграция клеток, изменения формы и дифференцировка, путем визуализации эмбриона по мере его развития. Это дополняет фиксированный анализ и расширяет понимание того, как развиваются органы во время эмбриогенеза. Несмотря на свои преимущества, живая визуализация редко используется в моделях мышей из-за ее технических проблем. Ранние эмбрионы мышей чувствительны при культивировании ex vivo и требуют эффективного обращения. Чтобы облегчить более широкое использование визуализации в реальном времени в исследованиях развития мышей, в этой статье представлен подробный протокол двухфотонной живой микроскопии, который позволяет проводить долгосрочные исследования в эмбрионах мышей. В дополнение к протоколу предоставляются советы по обращению с эмбрионами и оптимизации культивирования. Это поможет понять ключевые события в раннем органогенезе мышей, углубляя понимание биологии сердечно-сосудистых предшественников.
Introduction
Сердце формируется рано во время эмбриогенеза, чтобы начать перекачивать питательные вещества ко всему эмбриону, в то время как оно продолжает развиваться1. У мышиных эмбрионов через полтора дня после начала гаструляции на переднем полюсе 2,3 собирается рудиментарный орган сердца. На ранней стадии полосы (ES) сердечные предшественники в эпибласте проникают через примитивную полосу в зарождающийся мезодермальный слой 4,5,6 и начинают мигрировать к переднему полюсу, где они дифференцируются, образуя примитивную сердечную трубку. На протяжении всего этого процесса ранние предшественники сердца претерпевают клеточные перестройки, трансформации формы и дифференцировку в дополнение к миграции7 (рис. 1).
Ранние сердечные предшественники привлекали исследователей в течение почти столетия из-за их замечательной способности дифференцировать и строить функциональный орган одновременно. За последние два десятилетия клональный анализ и модели условного нокаута показали, что раннее развитие сердца вовлекает различные источники клеток в высокодинамичный процесс 8,9,10. Однако 3D-структура примитивной сердечной трубки и динамический характер ее морфогенеза затрудняют ее изучение (рис. 1), и мы далеки от понимания всей ее сложности11.
Для изучения этих динамических клеточных процессов методы визуализации в реальном времени теперь предлагают беспрецедентную детализацию 7,12,13,14. В мышиной модели живые подходы были ключом к исследованию тем разработки, которые трудно решить с помощью статического анализа 7,13,15. В то время как долгосрочное культивирование ex vivo и надежные микроскопические установки быстро развиваются16,17, немногие исследователи имеют опыт для успешного изображения живых эмбрионов. Несмотря на то, что бумажные публикации предоставляют достаточно технических подробностей для воспроизведения экспериментов с визуализацией в реальном времени, некоторые навыки и приемы трудно понять без визуальных примеров или помощи коллег. Чтобы ускорить этот процесс обучения и распространить использование визуализации в реальном времени среди лабораторий, мы собрали видеопротокол (рис. 2), который собирает необходимые навыки для выполнения визуализации в реальном времени на эмбрионах мышей-гаструляций.
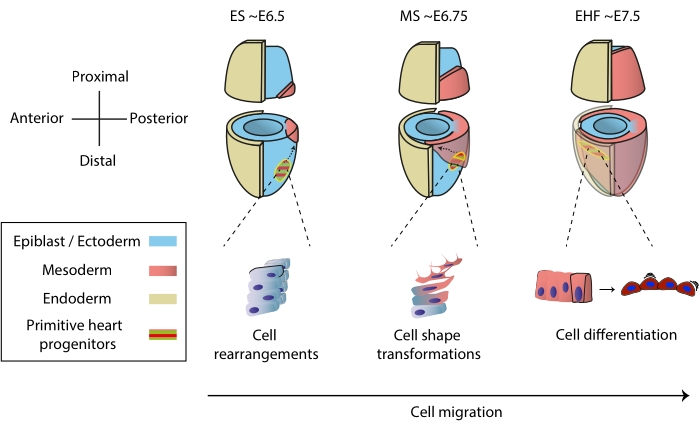
Рисунок 1: Ранняя дифференцировка клеток-предшественников сердца в эмбрионе мыши от начала гаструляции до стадии, предшествующей примитивному образованию сердечной трубки. Клетки-предшественники сердца проникают в мезодерму вскоре после начала гаструляции, мигрируя на противоположную сторону эмбриона. Морфологическая стадия и стадия эмбрионального дня (E) записываются поверх диаграмм. Пунктирными стрелками изображена траектория миграции примитивных прародителей сердечных трубок во время гаструляции. Эта цифра была адаптирована из11. Сокращения: ES = ранняя полоса; MS = средняя полоса; КВЧ = ранняя складка головы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
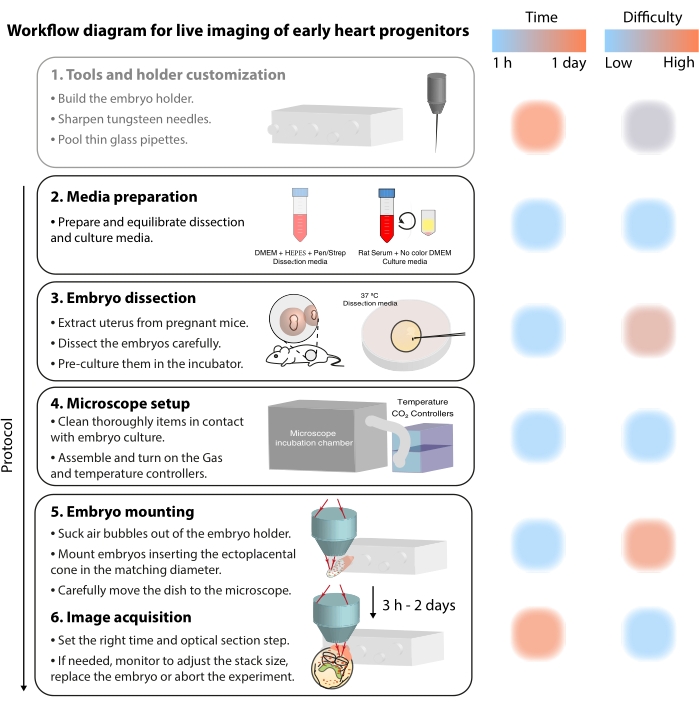
Рисунок 2: Диаграмма рабочего процесса для визуализации ранних предшественников сердца в реальном времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Ранние предшественники сердца организуются в примитивной сердечной трубке, которая начинает биться, пока она еще формируется. Понимание того, как происходит этот процесс, является ключом к точному определению широкого спектра врожденных пороков сердца до конкретных морфогенетически…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Авторы выражают благодарность д-ру Кензо Ивановичу за предыдущую работу над этим методом и группе д-ра Сигэнори Нонака (Национальный институт естественных наук, Япония) за предоставление первоначальных знаний по монтажу эмбрионов. Это исследование было поддержано грантом PGC2018-096486-B-I00 от Министерства науки и инноваций Испании и грантом H2020-MSCA-ITN-2016-722427 от программы ЕС «Горизонт 2020» для MT и грантом 1380918 от операционной программы FEDER Andalucía 2014-2020 для JND. MS был поддержан стипендией PhD Фонда La Caixa (LCF / BQ / DE18 / 11670014) и путешествующей стипендией Компании биологов (DEVTF181145). CNIC поддерживается Министерством науки Испании и Фондом ProCNIC.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
Referencias
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

