マウス胚における初期心臓前駆細胞のライブイメージング
Summary
心臓前駆細胞の3D +時間イメージングを可能にするマウス胚培養およびイメージングのための詳細なプロトコルを提示します。このビデオツールキットは、テキストのみの出版物では習得が困難なライブイメージングを成功させるために必要な主要なスキルに対応しています。
Abstract
心臓発達の最初のステップは、細胞の挙動と分化の劇的な変化を意味します。固定胚の解析では、静止画のスナップショットで特定の発生段階を詳細に研究することができますが、ライブイメージングでは、胚の発達を画像化することで、細胞の移動、形状変化、分化などの動的な形態形成イベントをキャプチャします。これは固定分析を補完し、胚形成中に臓器がどのように発達するかについての理解を広げます。その利点にもかかわらず、ライブイメージングは、その技術的な課題のためにマウスモデルで使用されることはめったにありません。初期のマウス胚は、 ex vivo で培養すると敏感であり、効率的な取り扱いが必要です。マウス発生研究におけるライブイメージングの幅広い使用を促進するために、この論文は、マウス胚での長期取得を可能にする2光子ライブ顕微鏡の詳細なプロトコルを提示します。プロトコルに加えて、胚の取り扱いと培養の最適化に関するヒントが提供されます。これは、初期のマウス器官形成における重要なイベントを理解するのに役立ち、心血管前駆細胞生物学の理解を深めます。
Introduction
心臓は胚形成の初期に形成され、胚全体に栄養素を送り込み始めますが、発達を続けます1。マウス胚では、原腸形成の開始から1日半後、初歩的な心臓器官が前極2,3に集合する。初期ストリーク(ES)段階までに、エピブラストの心臓前駆細胞は原始ストリークを通って新生中胚葉層4,5,6に侵入し、前極に移動し始め、そこで分化して原始心臓管を形成します。このプロセスを通して、初期の心臓前駆細胞は、遊走に加えて、細胞の再編成、形状転換、および分化を経験します7(図1)。
初期の心臓前駆細胞は、機能的な器官を同時に分化および構築する驚くべき能力により、ほぼ1世紀にわたって研究者を魅了してきました。過去20年間、クローン解析と条件付きノックアウトモデルは、初期の心臓発達が非常に動的なプロセスに異なる細胞源を関与させることを示しました8,9,10。しかし、原始的な心臓管の3D構造とその形態形成の動的な性質は、研究を困難にし(図1)、その完全な複雑さを理解するにはほど遠い11。
これらの動的な細胞プロセスを研究するために、ライブイメージング法は現在、前例のない詳細を提供します7、12、13、14。マウスモデルでは、静的解析では対処が困難な発達トピックを調査するためのライブアプローチが鍵となっています7,13,15。長期間の生体外培養と堅牢な顕微鏡セットアップは急速に進歩していますが16,17、生きた胚のイメージングを成功させる専門知識を持っている研究者はほとんどいません。紙ベースの出版物は、ライブイメージング実験を再現するのに十分な技術的詳細を提供しますが、視覚的な例やピアツーピアの支援がなければ、一部のスキルやトリックを把握することは困難です。この学習プロセスを加速し、ラボ間でライブイメージングの使用を広めるために、原腸マウス胚でライブイメージングを実行するために必要なスキルを収集するビデオプロトコル(図2)を組み立てました。
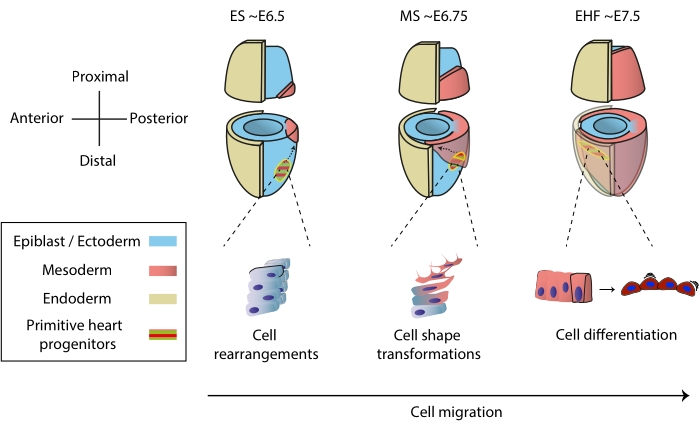
図1:原腸形成の開始から原始的な心臓管形成前の段階までのマウス胚における心臓前駆細胞の早期分化。 心臓前駆細胞は原腸形成の開始直後に中胚葉に侵入し、胚の反対側に移動する。形態学的および胚の日(E)段階は、図の上に書かれています。破線の矢印は、原腸形成中の原始心臓管前駆細胞の移行軌跡を示しています。この図は11から適応されました。略語:ES =初期のストリーク。MS =ミドルストリーク;EHF = 初期のヘッドフォールド。 この図の拡大版を表示するには、ここをクリックしてください。
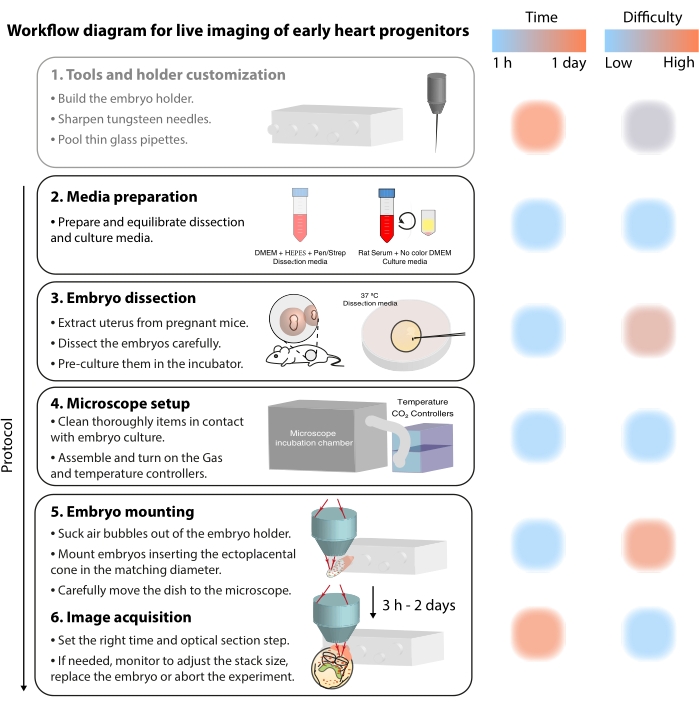
図2:初期心臓前駆細胞のライブイメージングのワークフロー図。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
初期の心臓前駆細胞は、それがまだ形成されている間に鼓動を開始する原始的な心臓管で組織化します。このプロセスがどのように行われるかを理解することは、特定の形態形成イベントに対する先天性心疾患の広い範囲を特定するための鍵です。そのために、ライブイメージングは、時間分解能を高めて正常および欠陥のある胚発生を研究する機会を提供します。これは、初期の心臓前駆?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
著者らは、この方法に関する以前の研究についてKenzo Ivanovitch博士と、胚マウントに関する初期の専門知識を提供した野中茂徳博士(自然科学研究機構)のグループを認めています。この研究は、スペイン科学大臣のGrant PGC2018-096486-B-I00と、EU Horizon 2020プログラムからMTへのGrant H2020-MSCA-ITN-2016-722427、およびFEDERアンダルシア2014-2020オペレーティングプログラムからJNDへの助成金1380918によってサポートされました。MSは、ラカイシャ財団博士フェローシップ(LCF / BQ / DE18 / 11670014)および生物学者旅行フェローシップ(DEVTF181145)によってサポートされました。CNICは、スペイン科学省とProCNIC財団によってサポートされています。
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
Referencias
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

