Imagem ao vivo de progenitores cardíacos precoces no embrião de camundongo
Summary
Apresentamos um protocolo detalhado para cultura e imagem de embriões de camundongos que permite imagens 3D + tempo de células progenitoras cardíacas. Este kit de ferramentas de vídeo aborda as principais habilidades necessárias para o sucesso da geração de imagens ao vivo, de outra forma difíceis de adquirir de publicações somente de texto.
Abstract
Os primeiros passos do desenvolvimento cardíaco implicam mudanças drásticas no comportamento e diferenciação celular. Enquanto a análise de embriões fixos permite estudar em detalhes estágios específicos de desenvolvimento em um instantâneo estático, a imagem ao vivo captura eventos morfogenéticos dinâmicos, como migração celular, mudanças de forma e diferenciação, por meio de imagens do embrião à medida que ele se desenvolve. Isso complementa a análise fixa e expande a compreensão de como os órgãos se desenvolvem durante a embriogênese. Apesar de suas vantagens, a imagem ao vivo raramente é usada em modelos de mouse por causa de seus desafios técnicos. Os embriões precoces de camundongos são sensíveis quando cultivados ex vivo e requerem manuseio eficiente. Para facilitar um uso mais amplo de imagens vivas em pesquisas de desenvolvimento de camundongos, este artigo apresenta um protocolo detalhado para microscopia viva de dois fótons que permite a aquisição a longo prazo em embriões de camundongos. Além do protocolo, são fornecidas dicas sobre manuseio de embriões e otimização da cultura. Isso ajudará a entender os principais eventos na organogênese precoce do camundongo, melhorando a compreensão da biologia do progenitor cardiovascular.
Introduction
O coração se forma cedo durante a embriogênese para começar a bombear nutrientes para todo o embrião, enquanto ele continua se desenvolvendo1. Em embriões de camundongos, um dia e meio após o início da gastrulação, um órgão cardíaco rudimentar se reúne no polo anterior 2,3. No estágio Early Streak (ES), os progenitores cardíacos no epiblasto ingressam através da estria primitiva para a camada mesodérmica nascente 4,5,6 e começam a migrar para o polo anterior, onde se diferenciam para formar o tubo cardíaco primitivo. Ao longo desse processo, os progenitores cardíacos precoces passam por rearranjos celulares, transformações de forma e diferenciação, além da migração7 (Figura 1).
Os primeiros progenitores cardíacos atraíram pesquisadores por quase um século devido à sua notável capacidade de diferenciar e construir um órgão funcional simultaneamente. Nas últimas duas décadas, a análise clonal e os modelos de knockout condicional mostraram que o desenvolvimento cardíaco precoce implica fontes celulares distintas em um processo altamente dinâmico 8,9,10. No entanto, a estrutura 3D do tubo cardíaco primitivo e a natureza dinâmica de sua morfogênese o tornam difícil de estudar (Figura 1), e estamos longe de compreender toda a sua complexidade11.
Para estudar esses processos celulares dinâmicos, os métodos de imagem ao vivo agora oferecem um detalhe sem precedentes 7,12,13,14. No modelo de camundongos, as abordagens ao vivo têm sido fundamentais para interrogar tópicos de desenvolvimento que são difíceis de abordar pela análise estática 7,13,15. Embora a cultura ex vivo de longo prazo e as configurações robustas de microscópio estejam avançando rapidamente16,17, poucos pesquisadores têm a experiência para obter imagens bem-sucedidas de embriões vivos. Embora as publicações baseadas em papel forneçam detalhes técnicos suficientes para reproduzir experimentos de imagem ao vivo, algumas habilidades e truques são difíceis de entender sem exemplos visuais ou assistência peer-to-peer. Para acelerar esse processo de aprendizagem e difundir o uso de imagens ao vivo entre os laboratórios, montamos um protocolo de vídeo (Figura 2) que reúne as habilidades necessárias para realizar imagens ao vivo em embriões de camundongos gastrulantes.
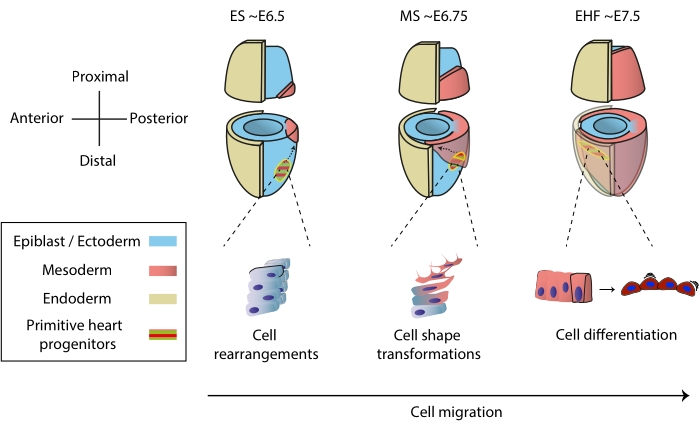
Figura 1: Diferenciação precoce das células progenitoras cardíacas no embrião de camundongo desde o início da gastrulação até o estágio que precede a formação primitiva do tubo cardíaco. As células progenitoras cardíacas entram no mesoderma logo após o início da gastrulação, migrando para o lado oposto do embrião. O estágio morfológico e embrionário do dia (E) é escrito em cima dos diagramas. As setas tracejadas retratam a trajetória de migração de progenitores primitivos do tubo cardíaco durante a gastrulação. Este número foi adaptado de11. Abreviaturas: ES = Early Streak; MS = Estria Média; EHF = Early Head Fold. Por favor, clique aqui para ver uma versão maior desta figura.
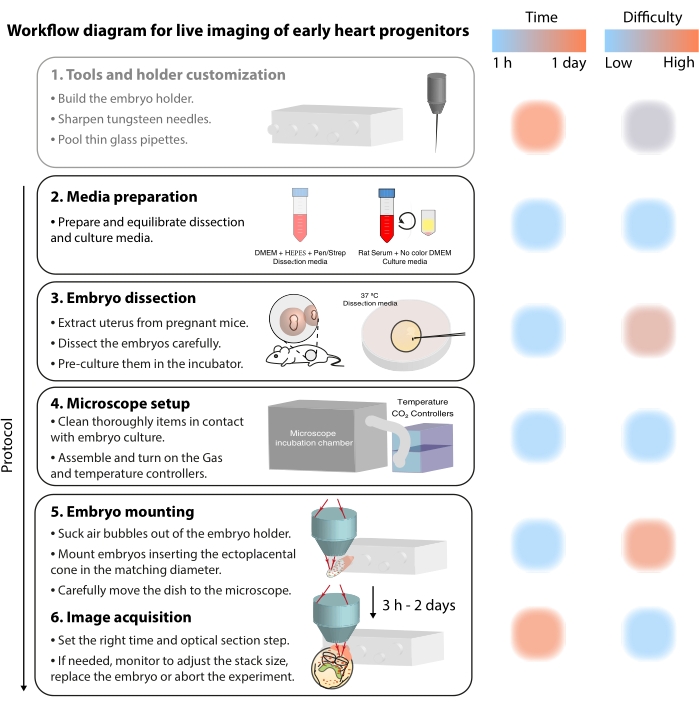
Figura 2: Diagrama de fluxo de trabalho para imagens ao vivo dos primeiros progenitores cardíacos. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Os primeiros progenitores cardíacos se organizam em um tubo cardíaco primitivo que começa a bater enquanto ainda está se formando. Entender como esse processo ocorre é fundamental para identificar o amplo espectro de defeitos cardíacos congênitos para eventos morfogenéticos específicos. Para isso, a imagem ao vivo oferece uma oportunidade de estudar o desenvolvimento embrionário normal e defeituoso com maior resolução temporal. Isso é especialmente útil para estudar as células progenitoras cardíacas preco…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Os autores reconhecem o Dr. Kenzo Ivanovitch pelo trabalho anterior sobre este método e o grupo do Dr. Shigenori Nonaka (Institutos Nacionais de Ciências Naturais, Japão) por fornecer a experiência inicial na montagem de embriões. Este estudo foi apoiado pelo Grant PGC2018-096486-B-I00 do Ministério da Ciência e Inovação espanhol e Grant H2020-MSCA-ITN-2016-722427 do programa EU Horizon 2020 para MT e Grant 1380918 do FEDER Andalucía 2014-2020 Programa Operacional para JND. O MS foi apoiado por uma bolsa de doutoramento da Fundação La Caixa (LCF/BQ/DE18/11670014) e pela bolsa itinerante da The Company of Biologists (DEVTF181145). O CNIC é apoiado pelo Ministério da Ciência espanhol e pela Fundação ProCNIC.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
Referencias
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

