Mesure du potentiel d’action optique unicellulaire dans les cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme
Summary
Nous décrivons ici l’acquisition optique et la caractérisation des potentiels d’action à partir de cardiomyocytes dérivés de cellules souches pluripotentes induites à l’aide d’un système de photométrie modulaire à grande vitesse.
Abstract
Les techniques conventionnelles de microélectrode intracellulaire pour quantifier l’électrophysiologie des cardiomyocytes sont extrêmement complexes, nécessitent beaucoup de main-d’œuvre et sont généralement réalisées à faible débit. L’expansion rapide et continue de la technologie des cellules souches pluripotentes induites (CSI) constitue une nouvelle norme dans la recherche cardiovasculaire et d’autres méthodes sont maintenant nécessaires pour augmenter le débit de données électrophysiologiques au niveau d’une seule cellule. VF2.1Cl est un colorant sensible à la tension récemment dérivé qui fournit une réponse rapide à canal unique et de grande magnitude aux fluctuations du potentiel membranaire. Il possède une cinétique supérieure à celle des autres indicateurs de tension existants et met à disposition des données fonctionnelles équivalentes à celles des techniques traditionnelles de microélectrode. Ici, nous démontrons une caractérisation simplifiée et non invasive du potentiel d’action dans des cardiomyocytes humains dérivés de l’iPSC à rythme externe à l’aide d’un système de photométrie modulaire et très abordable.
Introduction
La modélisation électrophysiologique des cardiomyocytes et la construction de plateformes efficaces pour le dépistage des médicaments cardiaques sont essentielles pour le développement de stratégies thérapeutiques pour une variété de troubles arythmiques. L’expansion rapide de la technologie des cellules souches pluripotentes induites (IPSC) a produit des percées prometteuses dans la modélisation des maladies humaines et l’investigation pharmacologique à l’aide de cardiomyocytes dérivés de patients isolés (iPSC-CM). Les techniques de « référence » pour la caractérisation électrophysiologique de ces cellules par patch-clamp (current-clamp) peuvent quantifier la morphologie et la durée du potentiel d’action (AP), cependant, cette méthode est incroyablement complexe et lente, et mal adaptée à l’acquisition de données à haut débit1. On rapporte régulièrement que les iPSC-CM ont un potentiel de membrane diastolique accru et un courant de fuite accru par rapport aux cardiomyocytes natifs adultes2. Il est suggéré que la plus petite taille des cellules et la capacité membranaire réduite observée dans les iPSC-CM peuvent produire une erreur systématique lors de l’utilisation de la technique de serrage de courant, expliquant peut-être ces écarts3. Afin de maximiser l’utilité d’une plate-forme iPSC-CM, une méthode supplémentaire est précieuse pour augmenter le débit et assurer la précision des données lors de la caractérisation des changements de tension transmembranaire au niveau d’une seule cellule dans les iPSC-CM.
Les colorants sensibles à la tension (VSD) sont depuis longtemps une méthode proposée pour fournir une analyse plus rapide, non invasive et équivalente de la cinétique des AP cardiaques par rapport à celles des techniques traditionnelles4. Une étude récente a démontré l’adéquation de la photométrie de sonde sensible à la tension ratiométrique pour quantifier avec précision l’APcardiaque 5. De plus, la capacité d’étendre facilement les approches de photométrie optique prête cette technique aux écrans de cardiotoxicité à grande échelle essentiels au développement de médicaments thérapeutiques (par exemple, CiPA). Le développement de protocoles de cardiotoxicité standardisés dans le cas d’une étude multi-sites en aveugle utilisant des techniques optiques de réseau de microélectrodes et de détection de tension a démontré la valeur clé de cette approche6.
De nombreux colorants potentiométriques sont disponibles dans le commerce, et le développement synthétique en cours de nouvelles sondes montre un potentiel passionnant pour rationaliser leur efficacité dans une variété de constructions cardiaques et neuronales. Le VSD idéal aura une cinétique et une sensibilité accrues, tout en affichant une diminution de la charge capacitive, du photobleaching et de la cytotoxicité. Le VF2.1Cl (FluoVolt) récemment synthétisé exprime bon nombre de ces propriétés bénéfiques en grande partie en raison de sa nouvelle structure moléculaire filaire, partagée par d’autres membres de la nouvelle famille VoltageFluor (VF)7. Contrairement aux VSD électrochromes courants dans lesquels de simples sondes se conjuguent moléculairement et électriquement à la membrane plasmique, ce colorant consiste en un fil synthétique inséré passivement et couvrant la membrane qui associe un donneur riche en électrons à un fluorophore de fluorescéine modifié (FITC). Les détails mécanistes sont fournis à la figure 1. Ce colorant démontre une excellente sensibilité aux fluctuations de tension de la membrane, affichant un changement de 27% de l’intensité d’émission par 100 mV contre environ 10% observé dans d’autres sondes courantes à des vitesses comparables7. En outre, les systèmes PeT à base de fil n’interagissent pas directement avec le champ électrique cellulaire, ce qui produit des interférences électriques minimales et des changements négligeables de la charge capacitive cellulaire.
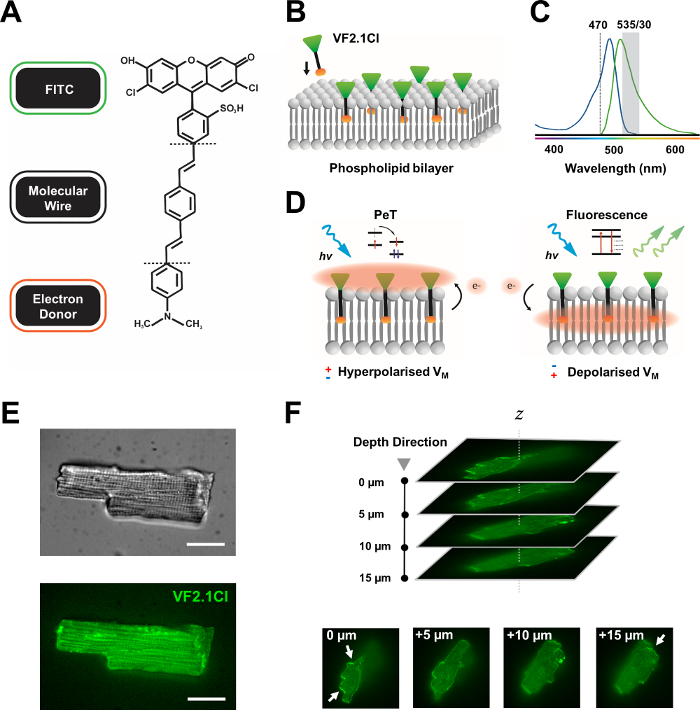
Figure 1 : Paramètres chimiques, spectraux et mécanistes du colorant VF2.1Cl. (A) Structure chimique de VF2.1Cl. Les caractéristiques moléculaires à noter comprennent de multiples groupes alkyles dans le fil moléculaire phénylène vinylène qui facilitent l’insertion dans la membrane plasmique. Un groupe d’acide sulfonique chargé négativement conjugué à la sonde FITC assure la stabilisation du fluorophore sur la surface extracellulaire et facilite l’insertion près perpendiculaire par rapport au champ électrique de la bicouche lipidique. (B) Schéma simplifié de VF2.1Cl perpendiculaire s’intégrant dans la membrane plasmique d’une cellule cible. (C) Spectres d’absorption et d’émission du colorant VF2.1Cl. Spectra est identique à celui des sondes FITC et GFP standard. (D) Représentation du mode d’action mécaniste de VF2.1Cl. Dans des conditions de repos (hyperpolarisées), des tensions intracellulaires négatives entraînent les électrons libres vers le fluorophore rostral. L’abondance d’électrons garantit que le transfert d’électrons photo-induit (PeT) est privilégié comme une voie hors de l’état excité après l’excitation optique, éteignant efficacement la fluorescence. En revanche, un potentiel membranaire dépolarisé influence le mouvement descendant des électrons favorisant la fluorescence lors de l’excitation optique. La réponse fluorescente qui en résulte est linéairement liée à la tension de la membrane et peut être utilisée avec précision pour recueillir des informations temporelles détaillées sur la cinétique électrophysiologique cellulaire. (E) Images représentatives en champ lumineux (supérieur) et fluorescence à 470 nm (inférieur) de cardiomyocytes de léporine chargés de VF2.1Cl. (F) Z pile d’un seul cardiomyocyte chargé. Les flèches indiquent les zones de localisation claire de VF2.1Cl à la membrane cellulaire. Les images ont été acquises avec un système confocal à disque rotatif composé d’une tête confocale à disque rotatif X-lightv3 avec un motif sténopé de 50 μm; Illuminateur LDI-7; Caméra Prime95B et objectif PlanApo Lambda 100x. Barre d’échelle : 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La sonde FITC conjuguée à VF2.1Cl garantit qu’elle peut être utilisée efficacement dans des configurations de filtre standard et GFP, et qu’elle ne nécessite qu’un système d’acquisition à canal unique, qui sont toutes deux des caractéristiques communes des plates-formes d’imagerie fluorescente. L’analyse de monocouches iPSC-CM humaines denses avec ce colorant a été récemment rapportée8,9,10,11. Notre protocole diffère de ces études en raison de notre étude des iPSC-CC uniques et isolés, non perturbés par les influences électriques et paracrines des monocouches syncytaires denses, et de notre utilisation d’un système de photométrie abordable et personnalisable par opposition à des arrangements complexes d’imagerie confocale ou à grand champ.
Nous décrivons ici notre protocole pour l’acquisition et l’analyse rapides de points d’accès optiques robustes à partir de cardiomyocytes humains isolés dérivés de l’iPSC et de cardiomyocytes natifs (voir Dossier supplémentaire). Nous utilisons VF2.1Cl couplé à une plate-forme de pointe personnalisable pour les mesures de photométrie à cellule unique. Ces protocoles expérimentaux ont été approuvés par le comité d’éthique du Centre médical universitaire de Göttingen (n° 10/9/15).
Protocol
Representative Results
Discussion
Nous décrivons ici un protocole de base permettant d’acquérir facilement des profils AP détaillés à partir d’iPSC-CM isolés adaptés à la modélisation électrophysiologique et au dépistage de médicaments cardiaques. Nous détectons des points d’accès réguliers et robustes à partir de nos iPSC-MC peu ensemencés, ce qui suggère à la fois la fonctionnalité des indicateurs et la fidélité méthodologique.
En raison du large éventail de méthodologies commerciales pour la r…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à remercier Cairn Research Ltd. pour leur aimable contribution financière qui a couvert les coûts de production de cette publication. De plus, nous remercions Mme Ines Mueller et Mme Stefanie Kestel pour leur excellent soutien technique.
Les recherches des auteurs sont soutenues par le Centre allemand de recherche cardiovasculaire (DZHK), la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 et dans le cadre de la stratégie d’excellence de l’Allemagne – EXC 2067/1- 390729940) et la Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochimie. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

