ヒト人工多能性幹細胞由来心筋細胞における単細胞光学作用電位測定
Summary
ここでは、高速モジュラーフォトメトリーシステムを用いた誘導多能性幹細胞由来心筋細胞からの作用電位の光学的獲得および特性評価について述べている。
Abstract
従来の細胞内微小電極技術は、心筋細胞電気生理学を定量する、極めて複雑で、労働集約的であり、典型的には低スループットで行われる。誘導多能性幹細胞(iPSC)技術の急速かつ継続的な拡大は、心血管研究における新しい標準を提示し、単一細胞レベルでの電気生理学的データのスループットを向上させるために代替方法が必要になりました。VF2.1Clは、膜電位の変動に対する急速な単一チャネル、高い強度応答を提供する最近得られた電圧感受性色素です。他の既存の電圧指標よりも優れた運動学を有し、従来の微小電極技術と同等の機能データを利用できます。ここでは、モジュール式で手頃な価格のフォトメトリーシステムを用いて、外部ペースのヒトiPSC由来心筋細胞における、単純化された非侵襲的作用電機の特性を実証する。
Introduction
心筋細胞の電気生理学的モデリングと心臓薬物スクリーニングのための効率的なプラットフォームの構築は、様々な不整脈障害の治療戦略の開発に不可欠です。誘導多能性幹細胞(iPSC)技術の急速な拡大は、単離患者由来心筋細胞(iPSC-CM)を用いたヒト疾患モデリングおよび薬理学的調査への有望な進出を生み出した。パッチクランプ(電流クランプ)を介してこれらの細胞の電気生理学的特徴付けのための「ゴールドスタンダード」技術は、作用電位(AP)形態および持続時間を定量化することができるが、この方法は非常に複雑で遅く、高スループットデータ取得1に適していない。iPSC-CMは、成人の天然心筋細胞2と比較して、拡張期膜電位が増加し、リーク電流が増加すると定期的に報告されている。iPSC-CMで観察される小さな細胞サイズおよび減少した膜容量は、電流クランプ技術を使用する際に系統的な誤差を生じさせる可能性があり、これらの偏差を説明する可能性が示唆される3。iPSC-CMプラットフォームの有用性を最大限に高めるためには、iPSC-CMで膜貫通電圧変化を単一のセルレベルで特性化する際のスループットとデータ精度を高めるため、追加の方法が重要です。
電圧感受性色素(VSD)は、従来の技術4と比較して、心臓AP動態のより速く、非侵襲的かつ同等の分析を提供する方法として提案されてきた。最近の研究では、レシオメトリック電圧感受性プローブフォトメトリーの適合性が、心臓AP5を正確に定量化することが実証されました。さらに、光学的な光測定のアプローチを容易にスケールアップする能力は、治療薬の開発に重要な大規模な心毒性スクリーン(例えば、CiPA)にこの技術を貸す。微小電極アレイと電圧感知光学技術を用いたブラインドマルチサイト研究における標準化された心毒性プロトコルの開発は、このアプローチの重要な価値を実証した6。
多くのポテンショメトリック色素は市販されており、新しいプローブの継続的な合成開発は、様々な心臓および神経構造にわたってその有効性を合理化するためのエキサイティングな可能性を示しています。理想的なVSDは、容量性負荷、光漂白および細胞毒性の低下を示しながら、運動および感受性を増強する。最近合成されたVF2.1Cl(FluoVolt)は、新しい電圧蛍光(VF)ファミリー7の他のメンバーが共有する、その新しいワイヤベースの分子構造に大きく起因するこれらの有益な特性の多くを表す。単純なプローブが分子的および電気的に化学接合する一般的なエレクトロクロミックVSDとは対照的に、この色素は、電子リッチドナーと修飾フルオロフォア(FITC)を組み合わせた受動的に挿入された膜スパン合成ワイヤーで構成されています。機械の詳細は 図 1に示されています。この色素は、膜電圧変動に対する優れた感度を示し、同等の速度で他の一般的なプローブに見られる〜10%とは対照的に、100mV当たりの発光強度の27%の変化を示す7。さらに、ワイヤベースのPeTシステムは、最小限の電気的干渉と細胞容量負荷のわずかな変化を生じるセルラー電界と直接相互作用しません。
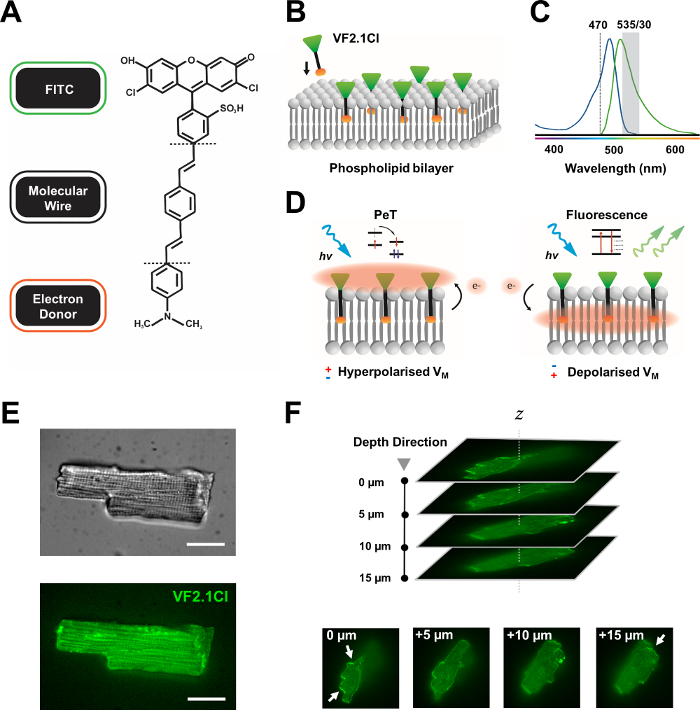
図1:VF2.1Cl色素の化学的、スペクトル的および機械的なパラメータ。(A)VF2.1Clの化学的構造. 注意すべき分子的特徴は、フェニレンビニレン分子線内の複数のアルキル基を含み、この細胞膜への挿入を容易にする。FITCプローブに結合した負の帯電スルホン酸基は、細胞外表面のフッ素酸安定化を保証し、脂質二重層の電界に対する垂直挿入に近い助けとなります。(B)標的細胞の細胞膜に埋め込む垂直VF2.1Clの簡略図である。(C)VF2.1Cl色素の吸収および発光スペクトル。スペクトルは、標準的なFITCおよびGFPプローブのそれと同じです。(D) VF2.1Clの作用の機械モードの描写。安静状態(過分極)では、負の細胞内電圧は、rostralフルオロフォアに向かって自由電子を駆動します。電子の存在量は光励起後の励起状態から外れる経路として光誘導電子移動(PeT)が好ましいこと、蛍光を効果的に消光することを保証する。これに対して、脱分極膜電位は、光学励起時に蛍光を好む下向きの電子移動に影響を与える。得られた蛍光応答は膜電圧に直線的に関連しており、細胞電生理学的運動に関する詳細な時間情報を収集するために正確に利用することができる。(E)VF2.1Clを搭載したレポリン心筋細胞の470nm(下)画像における代表的な明視野(上)および蛍光(F)単一の装填された心筋細胞のZスタック。矢印は、細胞膜へのVF2.1Clの明確な局在の領域を示す。画像は、50 μmのピンホールパターンを持つX-lightv3回転ディスク共焦点ヘッドからなる回転ディスク共焦点システムで取得されました。LDI-7イルミエーター;Prime95BカメラとPlanApoラムダ100xの目的。スケールバー:20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
VF2.1Clに結合したFITCプローブは、標準フィルタ構成およびGFPフィルタ構成下で効果的に使用できることを保証し、単一のチャネル取得システムのみが必要であり、どちらも蛍光イメージングプラットフォームの共通の特徴です。この色素を用いた高密度ヒトiPSC-CM単層の解析は、最近8、9、10、11と報告されている。我々のプロトコルは、緻密な一層の電気的およびパラクリンの影響によって妨げられない単一の孤立したiPSC-CMの調査と、複雑な共焦点または広視野イメージングの取り決めとは対照的に、手頃でカスタマイズ可能なフォトメトリーシステムの使用のために、これらの研究とは異なる。
ここでは、孤立したヒトiPSC由来の心筋細胞およびネイティブ心筋細胞からの堅牢な光学APの迅速な取得と分析のためのプロトコルについて説明 します(補足ファイルを参照)。我々は、単一細胞のフォトメトリー測定のための最先端のプラットフォームのカスタマイズ可能な状態と結合されたVF2.1Clを使用する。これらの実験プロトコルは、大学医療センターゲッティンゲン(No. 10/9/15)の倫理委員会によって承認されています。
Protocol
Representative Results
Discussion
電気生理学的モデリングや心臓薬スクリーニングに適した単離されたiPSC-CMから詳細なAPプロファイルを容易に取得するための基本的なプロトコルについて説明する。私たちは、インジケーター機能と方法論的忠実性の両方を示唆する、まばらなシードのiPSC-CMから定期的で堅牢なAPを検出します。
iPSCリプログラミングのための商業的方法論の広いスペクトルと心臓分化プ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
著者らは、この出版物の生産コストをカバーする彼らの種類の財政的貢献のためにケアンリサーチ株式会社を認めたいと思います。さらに、イネス・ミューラー氏とステファニー・ケステル氏の優れた技術サポートに感謝します。
著者らの研究は、ドイツ心臓血管研究センター(DZHK)、ドイツフォルシュングスゲミンシャフト(DFG、 ドイツ研究財団、VO 1568/3-1、IRTG1816 RP12、SFB1002 TPA13、ドイツのエクセレンス戦略の下で – EXC 2067/1- 390729940)とエルゼ・クレナー・フレゼニウス・スティフトゥン(EKFS)2016_A20 FS)。
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochimie. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

