Medição potencial de ação óptica unicelular em cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos
Summary
Aqui descrevemos a aquisição óptica e a caracterização de potenciais de ação a partir de cardiomiócitos derivados de células-tronco pluripotentes induzidos usando um sistema de fotometria modular de alta velocidade.
Abstract
As técnicas convencionais de microeletrodos intraecelulares para quantificar a eletrofisiologia cardiomiocócica são extremamente complexas, intensivas em mão-de-obra e tipicamente realizadas em baixo rendimento. A rápida e contínua expansão da tecnologia de células-tronco pluripotentes induzidas (iPSC) apresenta um novo padrão em pesquisa cardiovascular e métodos alternativos são agora necessários para aumentar o throughput de dados eletrofisiológicos em um único nível celular. VF2.1Cl é um corante sensível à tensão recentemente derivado que fornece uma resposta rápida de canal único e de alta magnitude às flutuações no potencial da membrana. Possui cinética superior às de outros indicadores de tensão existentes e disponibiliza dados funcionais equivalentes aos das técnicas tradicionais de microeletrodo. Aqui, demonstramos uma caracterização potencial de ação simplificada e não invasiva em cardiomiócitos derivados do iPSC humanos com ritmo externo usando um sistema de fotometria modular e altamente acessível.
Introduction
A modelagem eletrofisiológica de cardiomiócitos e a construção de plataformas eficientes para rastreamento de medicamentos cardíacos é essencial para o desenvolvimento de estratégias terapêuticas para uma variedade de distúrbios arrítmicos. A rápida expansão da tecnologia de células-tronco pluripotentes induzidas (iPSC) produziu incursões promissoras na modelagem de doenças humanas e na investigação farmacológica usando cardiomiócitos isolados derivados do paciente (iPSC-CM). Técnicas “padrão-ouro” para caracterização eletrofisiológica dessas células através de patch-clamp (grampo atual) podem quantificar o potencial de ação (AP) morfologia e duração, no entanto, este método é incrivelmente complexo e lento, e não é adequado para aquisição de dados de alto rendimento1. IPSC-CMs são regularmente relatados como com um potencial de membrana diastólica aumentada e aumento da corrente de vazamento quando comparados aos cardiomiócitos nativos adultos2. Sugere-se que o tamanho celular menor e a redução da capacitância da membrana observada nos iPSC-CMs podem produzir algum erro sistemático ao usar a técnica de grampo atual, talvez explicando esses desvios3. A fim de maximizar a utilidade de uma plataforma iPSC-CM, um método adicional é valioso para aumentar o throughput e garantir a precisão dos dados ao caracterizar alterações de tensão transmembrana em um único nível celular em iPSC-CMs.
Os corantes sensíveis à tensão (VSD) têm sido há muito tempo um método proposto para fornecer análises mais rápidas, não invasivas e equivalentes da cinética AP cardíaca comparativa com as das técnicas tradicionais4. Um estudo recente demonstrou a adequação da fotometria da sonda sensível à tensão racionmétrica para quantificar com precisão o AP5cardíaco . Além disso, a capacidade de escalar prontamente abordagens de fotometria óptica empresta essa técnica a telas de cardiotoxicidade em larga escala críticas no desenvolvimento de medicamentos terapêuticos (por exemplo, CiPA). O desenvolvimento de protocolos padronizados de cardiotoxicidade em um estudo cego de vários sites usando matriz de microeletrodos e técnicas ópticas de sensoriamento de tensão demonstrou o valor-chave desta abordagem6.
Muitos corantes potencialiométricos estão comercialmente disponíveis, e o desenvolvimento sintético contínuo de novas sondas mostra um potencial empolgante para simplificar sua eficácia em uma variedade de construções cardíacas e neurais. O VSD ideal terá cinética aumentada e sensibilidade, enquanto exibe menor carga capacitiva, fotobleaching e citotoxicidade. O recém-sintetizado VF2.1Cl (FluoVolt) expressa muitas dessas propriedades benéficas em grande parte devido à sua nova estrutura molecular baseada em fios, compartilhada por outros membros da nova família VoltageFluor (VF)7. Em contraste com vsds eletrocrômicos comuns em que sondas simples molecular e eletricamente conjugam à membrana plasmática, este corante consiste em um fio sintético passivamente inserido, de abrangência de membrana, que emparelha um doador rico em elétrons com um fluoróforo de fluoresceína modificada (FITC). Detalhes mecanicistas são fornecidos na Figura 1. Este corante demonstra excelente sensibilidade às flutuações de tensão da membrana, exibindo uma mudança de 27% na intensidade de emissão por 100 mV em oposição a ~10% visto em outras sondas comuns a velocidadescomparáveis 7. Além disso, os sistemas PeT baseados em fios não interagem diretamente com o campo elétrico celular que produz interferência elétrica mínima e mudanças insignificantes na carga capacitiva celular.
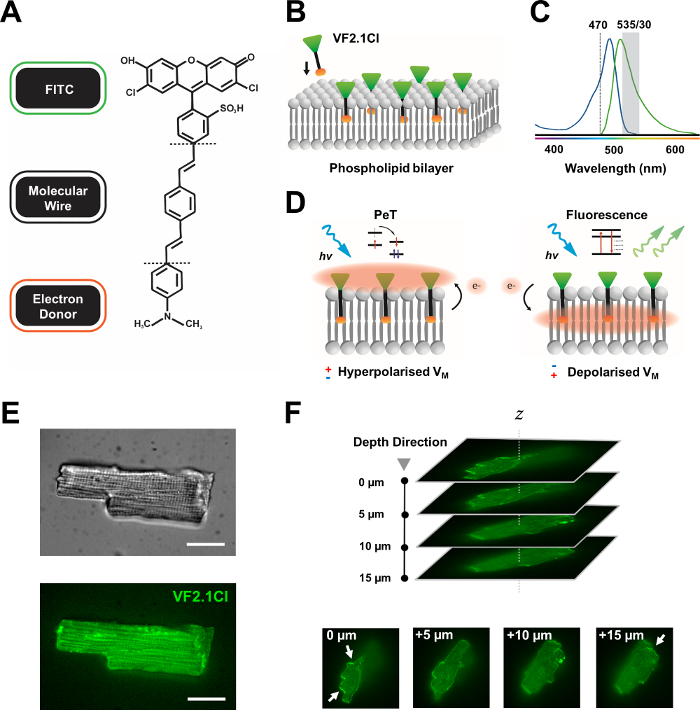
Figura 1: Parâmetros químicos, espectrais e mecanicistas de corante VF2.1Cl. (A) Estrutura química de VF2.1Cl. Características moleculares a notar incluem múltiplos grupos de alquila dentro do fio molecular de fenileno vinylene que facilitam a inserção na membrana plasmática. Um grupo de ácido sulfônico carregado negativamente conjugado à sonda FITC garante estabilização de fluoróforo na superfície extracelular e auxilia perto da inserção perpendicular em relação ao campo elétrico da bicamada lipídica. (B) Um esquema simplificado de VF2.1Cl perpendicular incorporando na membrana plasmática de uma célula alvo. (C) Espectro de absorção e emissão de corante VF2.1Cl. O espectro é idêntico ao dos testes FITC e GFP padrão. (D) Representação do modo mecanicista de ação de VF2.1Cl. Em condições de repouso (hiperpolarizadas), tensões intracelulares negativas conduzem elétrons livres em direção ao fluoróforo rostral. A abundância de elétrons garante que a transferência de elétrons induzidos por foto (PeT) seja favorecida como um caminho para fora do estado animado após a excitação óptica, efetivamente saciando a fluorescência. Em contraste, um potencial de membrana despolarizada influencia o movimento de elétrons descendentes favorecendo a fluorescência após a excitação óptica. A resposta fluorescente resultante está linearmente relacionada à tensão da membrana e pode ser precisamente utilizada para coletar informações temporais detalhadas sobre cinética eletrofisiológica celular. (E) Representativo brightfield (superior) e fluorescência a 470 nm (inferior) imagens de cardiomiócitos leporina carregados com VF2.1Cl. (F) Z pilha de um único cardiomiócito carregado. As setas indicam áreas de localização clara de VF2.1Cl para a membrana celular. As imagens foram adquiridas com um sistema confocal de disco giratório consistindo de uma cabeça confocal de disco giratório X-lightv3 com um padrão de pinhole de 50 μm; Iluminador LDI-7; Câmera Prime95B e um objetivo PlanApo Lambda 100x. Barra de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.
A sonda FITC conjugada ao VF2.1Cl garante que ele pode ser usado efetivamente sob configurações padrão e filtro GFP, e requer apenas um único sistema de aquisição de canais, ambos características comuns de plataformas de imagem fluorescentes. A análise de monocamadas humanas densas com este corante foi recentemente relatada8,9,10,11. Nosso protocolo difere desses estudos devido à nossa investigação de iPSC-CMs únicos e isolados, imperturbáveis pelas influências elétricas e paracrinas de monocamadas sincicial densas, e pelo uso de um sistema de fotometria acessível e personalizável em oposição a complexos arranjos de imagem confocal ou de campo amplo.
Aqui, descrevemos nosso protocolo para a rápida aquisição e análise de APs ópticos robustos de cardiomiócitos isolados derivados do iPSC e cardiomiócitos nativos (ver Arquivo Suplementar). Usamos VF2.1Cl juntamente com uma plataforma de última geração personalizável para medições de fotometria de célula única. Esses protocolos experimentais foram aprovados pelo comitê de ética do Centro Médico Universitário Göttingen (nº 10/9/15).
Protocol
Representative Results
Discussion
Aqui descrevemos um protocolo básico para adquirir facilmente perfis de AP detalhados de iPSC-CMs isolados adequados para modelagem eletrofisiológica e rastreamento de medicamentos cardíacos. Detectamos APs regulares e robustos de nossos iPSC-CMs pouco semeados, o que sugere a funcionalidade do indicador e a fidelidade metodológica.
Devido ao amplo espectro de metodologias comerciais para reprogramação do iPSC e falta de padronização para protocolos de diferenciação cardíaca, os mod…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de reconhecer a Cairn Research Ltd. por sua gentil contribuição financeira que cobria os custos de produção desta publicação. Além disso, agradecemos à Sra. Ines Mueller e à Sra. Stefanie Kestel pelo excelente apoio técnico.
A pesquisa dos autores é apoiada pelo Centro Alemão de Pesquisa Cardiovascular (DZHK), o Deutsche Forschungsgemeinschaft (DFG, German Research Foundation, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 e sob a Estratégia de Excelência da Alemanha – EXC 2067/1- 390729940) e o Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochimie. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

