Caratterizzazione di una nuova tecnica di coltura retinica organotipica umana
Summary
Questo studio mira a sviluppare un nuovo modello di coltura retinica organotipica umana (HORC) che impedisce di compromettere l’integrità retinica durante la manipolazione dell’espianto. Ciò si ottiene coltivando la retina con il vitreo sovrastante e il pigmento retinico sottostante epitelio-coroide (RPE-coroide) e sclera.
Abstract
Precedenti modelli di coltura retinica organotipica umana (HORC) hanno utilizzato retine staccate; tuttavia, senza il supporto strutturale conferito dall’epitelio-coroide pigmentato retinico (RPE-coroide) e dalla sclera, l’integrità della retina fragile può essere facilmente compromessa. Lo scopo di questo studio era quello di sviluppare un nuovo modello HORC che contiene la retina, la coroide RPE e la sclera per mantenere l’integrità retinica durante la coltura di espianti retinici.
Dopo aver tagliato circonferenzialmente lungo il limbus per rimuovere l’iride e la lente, sono state fatte quattro incisioni profonde per appiattire la oculare. In contrasto con i precedenti protocolli HORC, una trefina è stata utilizzata per tagliare non solo la retina, ma anche la coroide RPE e la sclera. Gli espianti a triplo strato risultanti sono stati coltivati per 72 ore. La colorazione di ematossilina ed eosina (H & E) è stata utilizzata per valutare le strutture anatomiche e gli espianti retinici sono stati ulteriormente caratterizzati dall’immunoistochimica (IHC) per l’apoptosi, l’integrità delle cellule di Müller e l’infiammazione della retina. Per confermare la possibilità di induzione della malattia, gli espianti sono stati esposti a glucosio alto (HG) e citochine pro-infiammatorie (Cyt), per imitare la retinopatia diabetica (DR). Il test delle perle magnetiche Luminex è stato utilizzato per misurare le citochine correlate al DR rilasciate nel terreno di coltura.
La colorazione H&E ha rivelato lamelle retiniche distinte e nuclei compatti negli espianti retinici con la coroide RPE e la sclera sottostanti, mentre le retine senza le strutture sottostanti hanno mostrato uno spessore ridotto e una grave perdita di nuclei. I risultati dell’IHC hanno indicato l’assenza di apoptosi e infiammazione retinica, nonché l’integrità delle cellule di Müller preservata. I saggi Luminex hanno mostrato un aumento significativo della secrezione di citochine pro-infiammatorie associate a DR in espianti retinici esposti a HG + Cyt rispetto ai livelli basali a 24 ore.
Abbiamo sviluppato e caratterizzato con successo un nuovo protocollo HORC in cui l’integrità retinica è stata preservata senza apoptosi o infiammazione retinica. Inoltre, la secrezione indotta di biomarcatori pro-infiammatori associati a DR quando espone espianti retinici a HG + Cyt suggerisce che questo modello potrebbe essere utilizzato per studi clinicamente traducibili sulle malattie retiniche.
Introduction
La retina è una struttura oculare altamente specializzata responsabile della trasformazione dell’energia luminosa in entrata in segnali elettrici, che vengono poi elaborati dal cervello per la percezione visiva. La retina umana contiene una gamma dinamica di tipi cellulari, altamente organizzati in un’unica struttura lamellare costituita da due strati sinaptici e tre nuclei1 (Figura 1). L’omeostasi retinica è sostenuta dalle intricate connessioni tra cellule neuroretiniche, vasi sanguigni, nervi, tessuti connettivi e RPE1. A causa della sofisticata anatomia e fisiologia retinica, i meccanismi di molte malattie della retina rimangono ancora poco compresi2,3,4,5. Per studiare meglio le malattie della retina, sono stati sviluppati modelli HORC6,7,8,9. Rispetto agli studi sugli animali e alle colture in vitro, i modelli HORC sono vantaggiosi perché mantengono l’ambiente cellulare dinamico e le complesse interazioni neurovascolari in situ, fornendo un buon modello per la traduzione clinica.
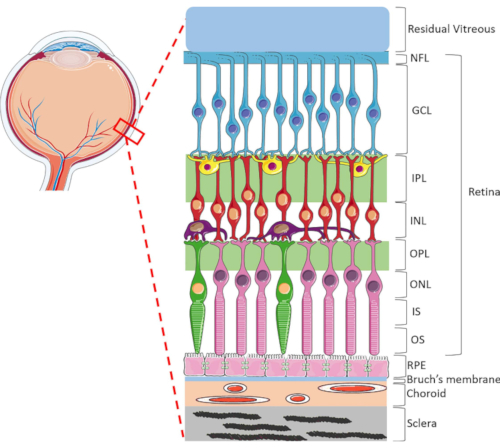
Figura 1: Strutture oculari posteriori dell’occhio umano. Da anteriore a posteriore, gli strati retinici sono: strato di fibre nervose (NFL), strato di cellule gangliari (GCL), strato plessiforme interno (IPL), strato nucleare interno (INL), strato plessiforme esterno (OPL), strato nucleare esterno (ONL), segmento interno del fotorecettore (IS) e strato esterno del fotorecettore (OS). Le cellule all’interno della retina includono cellule gangliari (blu), cellule amacrine (giallo), cellule bipolari (rosse), cellule orizzontali (viola), fotorecettori a bastoncello (rosa) e fotorecettori a cono (verde). Il vitreo si trova anteriormente alla retina. L’RPE, la membrana di Bruch, la coroide e la sclera si trovano posteriormente alla retina. Si noti che l’immagine mostrata è solo una rappresentazione schematica della retina e il rapporto tra cellule e connettività retinica all’interno di ciascuno strato potrebbe non essere indicativo dell’impostazione in vivo. Fare clic qui per visualizzare una versione più grande di questa figura.
I protocolli HORC precedentemente caratterizzati6,7,8,9 hanno comportato la separazione della retina dalla coroide RPE sottostante e dalla sclera utilizzando una trefina chirurgica. Tuttavia, senza il supporto fornito da queste strutture sottostanti, la retina traslucida diventa fragile, difficile da maneggiare e strumenti come la pince possono facilmente interrompere la sua integrità. Inoltre, l’isolamento della retina in coltura senza RPE ha dimostrato di causare apoptosi delle cellule gangliari e degenerazione dei fotorecettori10,11,12. Pertanto, sarebbe utile un protocollo HORC alternativo che riduca al minimo la perdita di integrità retinica e imiti meglio l’ambiente in vivo. Ciò è particolarmente importante quando si studiano i meccanismi della malattia retinica, poiché le lesioni fisiche durante la manipolazione dell’espianto potrebbero introdurre artefatti. Pertanto, lo scopo di questo studio era quello di sviluppare un nuovo modello HORC che includa la coroide RPE e la sclera al fine di proteggere l’integrità retinica durante la manipolazione e la coltura dell’espianto.
Per raggiungere questo obiettivo sono stati estratti espianti retinici “inseriti” tra il vitreo residuo e la sottostante RPE-coroide e sclera. Negli espianti sandwich, il vitreo appesantisce la retina per evitare il distacco e il ripiegamento della retina, mentre la sclera dura e fibrosa funge sia da impalcatura per il supporto strutturale che da punto di contatto per la pinna. Inoltre, modelli animali hanno dimostrato che il mantenimento dell’RPE in coltura può prevenire la degenerazione retinica e la proliferazione gliale, una risposta delle cellule di Müller a segnali di pericolo come ipossia e infiammazione10,11,12.
Per caratterizzare il modello, gli espianti retinici sandwich sono stati colorati con ematossilina ed eosina (H & E) per valutare le strutture anatomiche ed è stata eseguita l’immunoistochimica (IHC), etichettando gli espianti con deossinucleotidiltransferasi terminale dUTP nick end labeling (TUNEL, un marcatore cellulare apoptotico), proteina acida fibrillare gliale (GFAP, un’infiammazione retinica e marcatore di attivazione delle cellule di Müller) e vimentina, un marcatore dell’integrità cellulare di Müller. Per determinare se questo modello può essere indotto a sviluppare segni molecolari di malattia, gli espianti sono stati esposti ad alto livello di glucosio (HG) con citochine pro-infiammatorie (Cyt), interleuchina-1β (IL-1β) e fattore di necrosi tumorale-α (TNF-α), un ambiente di coltura che ha dimostrato di imitare la retinopatia diabetica (DR) in entrambi i modelli di malattia cellulare e animale13,14,15. I saggi Luminex sono stati utilizzati nel modello DR per misurare le citochine rilasciate nel terreno di coltura.
Protocol
Representative Results
Discussion
HORC è attualmente il modello clinicamente più traducibile nella ricerca preclinica retinica. Rispetto ai modelli di coltura cellulare in vitro, HORC può rappresentare meglio l’anatomia della retina umana in situ, attraverso il mantenimento dei tipi di cellule retiniche dinamiche e delle loro connessioni con neuroni, vascolari e ambiente extracellulare19. Rispetto ai modelli animali, gli HORC sono più vantaggiosi nello studio della fisiopatologia e nella progettazione di trattamenti farmaceuti…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare i generosi donatori di tessuti oculari e il team della New Zealand National Eye Bank per il loro sostegno. Questo lavoro è stato sostenuto finanziariamente da sovvenzioni di progetto del Maurice and Phyllis Paykel Trust e della Auckland Medical Research Foundation (1117015). La direzione di IDR è sostenuta dalla Buchanan Charitable Foundation. La borsa di studio di CK è fornita dal New Zealand Association of Optometrists Education and Research Fund (CC36812) e la borsa di studio di HHL è fornita dalla Buchanan Charitable Foundation.
Materials
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors – Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe’s Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe’s Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).

