Caracterização de uma nova técnica de cultura de retina organotipípica humana
Summary
Este estudo tem como objetivo desenvolver um novo modelo de cultura de retina organotípica humana (HORC) que previne comprometer a integridade da retina durante o manuseio da explant. Isso é conseguido através da cultura da retina com o vítreo sobrelada e o pigmento de retina subjacente epitélio-coroide (RPE-choroid) e esclera.
Abstract
Modelos anteriores de cultura de retina organotípica humana (HORC) utilizaram retinas descoladas; no entanto, sem o suporte estrutural conferido pelo pigmento da retina epitélio-coroide (RPE-choroid) e esclera, a integridade da frágil retina pode ser facilmente comprometida. O objetivo deste estudo foi desenvolver um novo modelo HORC que contenha a retina, RPE-choroid e esclera para manter a integridade da retina ao esculpir explants da retina.
Depois de cortar circunferencialmente ao longo do limbus para remover íris e lente, quatro incisões profundas foram feitas para achatar a xícara ocular. Em contraste com os protocolos HORC anteriores, uma trefina foi usada para cortar não apenas a retina, mas também o RPE-coroid e esclera. As explantas de três camadas resultantes foram cultivadas por 72 h. A coloração de hematoxilina e eosina (H&E) foi utilizada para avaliar estruturas anatômicas e as explanações da retina foram ainda caracterizadas pela imunohistoquímica (IHC) para apoptose, integridade celular de Müller e inflamação da retina. Para confirmar a possibilidade de indução da doença, explantas foram expostas a citocinas pró-inflamatórias (Cyt), para imitar a retinopatia diabética (DR). O ensaio de contas magnéticas Luminex foi usado para medir citocinas relacionadas à DR liberadas no meio da cultura.
A coloração de H&E revelou lamellae de retina distinta e núcleos compactos em explantas de retina com o RPE-coroide e esclera subjacentes, enquanto as retinas sem as estruturas subjacentes apresentaram espessura reduzida e perda severa de núcleos. Os resultados do IHC indicaram ausência de apoptose e inflamação da retina, bem como a integridade celular de Müller preservada. Os ensaios luminex mostraram significativamente aumentado a secreção de citocinas pró-inflamatórias associadas à DR em explantas de retina expostas a HG + Cyt em relação aos níveis de linha de base a 24 h.
Desenvolvemos e caracterizamos com sucesso um novo protocolo HORC no qual a integridade da retina foi preservada sem apoptose ou inflamação da retina. Além disso, a secreção induzida de biomarcadores pró-inflamatórios associados à DR ao expor explantas de retina ao HG + Cyt sugere que este modelo poderia ser usado para estudos clinicamente traduzíveis da doença da retina.
Introduction
A retina é uma estrutura ocular altamente especializada responsável por transformar energia leve de entrada em sinais elétricos, que são então processados pelo cérebro para percepção visual. A retina humana contém uma gama dinâmica de tipos celulares, altamente organizada em uma estrutura lamelar única composta por duas camadas sinápticas e três núcleos1 (Figura 1). A homeostase da retina é sustentada pelas intrincadas conexões entre células neuroretinais, vasos sanguíneos, nervos, tecidos conjuntivos e o RPE1. Devido à sofisticada anatomia e fisiologia da retina, os mecanismos de muitas doenças da retina ainda permanecem mal compreendidos2,3,4,5. Para melhor estudar as doenças da retina, foram desenvolvidos modelos HORC6,7,8,9. Em comparação com estudos em animais e culturas in vitro, os modelos HORC são vantajosos porque mantêm o ambiente celular dinâmico e interações neurovasculares complexas in situ, proporcionando um bom modelo para tradução clínica.
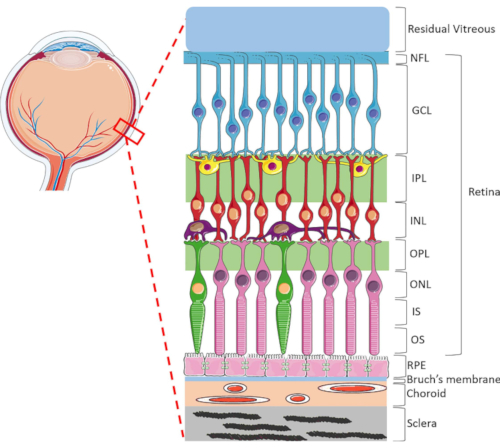
Figura 1: Estruturas oculares posteriores do olho humano. Anterior a posterior, as camadas de retina são: camada de fibra nervosa (NFL), camada de célula de glion (GCL), camada plexiforme interna (IPL), camada nuclear interna (INL), camada plexiforme externa (OPL), camada nuclear externa (ONL), segmento interno do fotoreceptor (IS) e camada externa fotorreceptora (OS). As células dentro da retina incluem células de gânglio (azul), células amacrinas (amarelas), células bipolares (vermelhas), células horizontais (roxas), fotorreceptores de vara (rosa) e fotorreceptores de cone (verde). O vítreo está localizado anterior à retina. O RPE, a membrana de Bruch, coroide e esclera estão localizados posteriormente à retina. Observe que a imagem mostrada é apenas uma representação esquemática da retina e a razão de conectividade celular/retina dentro de cada camada pode não ser indicativa do cenário in vivo. Clique aqui para ver uma versão maior desta figura.
Os protocolos HORC anteriormente caracterizados6,7,8,9 envolveram a separação da retina do RPE-coroide e esclera subjacentes utilizando uma trefina cirúrgica. No entanto, sem o suporte fornecido por essas estruturas subjacentes, a retina translúcida torna-se frágil, difícil de manusear e ferramentas como fórceps podem facilmente interromper sua integridade. Além disso, isolar a retina na cultura sem o RPE tem sido demonstrada como causa de apoptose de células gânglios e degeneração fotorreceptora10,11,12. Assim, um protocolo HORC alternativo que minimize a perda da integridade da retina e imite melhor o ambiente in vivo seria útil. Isso é particularmente importante ao estudar mecanismos de doenças da retina, pois lesões físicas durante o manuseio de explant podem introduzir artefatos. Por isso, o objetivo deste estudo foi desenvolver um novo modelo HORC que inclua o RPE-choroid e a esclera, a fim de proteger a integridade da retina durante o manuseio e cultura da explant.
Para atingir esse objetivo, foram extraídas explanações de retina “sanduíche” entre o vítreo residual e o RPE-coroide e esclera subjacentes. Nas explantas do sanduíche, o vítreo pesa para baixo da retina para evitar o descolamento e a dobra da retina, enquanto a esclera resistente e fibrosa atua tanto como um andaime para suporte estrutural quanto um ponto de contato para fórceps. Além disso, modelos animais têm demonstrado que a retenção do RPE na cultura pode prevenir a degeneração da retina e a proliferação gliana, uma resposta das células de Müller a sinais de perigo como hipóxia e inflamação10,11,12.
Para caracterizar o modelo, foram realizadas explanações de retina sanduíche com Hemaoxilalina e Eosina (H&E) para avaliar estruturas anatômicas e imunohistoquímica (IHC), rotulagem explants com terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL, um marcador de célula apoptótica), proteína ácida fibrilar gliana (GFAP, uma inflamação da retina e marcador de ativação celular Müller), e vimentina, um marcador de integridade celular Müller. Para determinar se esse modelo pode ser induzido a desenvolver sinais de doença molecular, as explantas foram expostas à alta glicose (HG) com citocinas pró-inflamatórias (Cyt), interleucina-1β (IL-1β) e fator-α tumoral (TNF-α), ambiente de cultivo que tem sido mostrado para imitar a retinopatia diabética (DR) nos modelos de doenças celulares e animais13,14,15. Os ensaios luminex foram utilizados no modelo DR para medir citocinas liberadas no meio da cultura.
Protocol
Representative Results
Discussion
HORC é atualmente o modelo mais clinicamente traduzível em pesquisas pré-clínicas de retina. Em comparação com modelos de cultura celular in vitro, o HORC pode representar melhor a anatomia da retina humana in situ, através da retenção dos tipos dinâmicos de células da retina e suas conexões com neurônios, vasculaturas e o ambiente extracelular19. Em comparação com os modelos animais, o HORC é mais vantajoso no estudo da fisiopatologia e na concepção de tratamentos farmacêuticos…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer aos generosos doadores de tecidos oculares e à equipe do Banco Nacional de Olhos da Nova Zelândia pelo apoio. Este trabalho foi apoiado financeiramente por subvenções do projeto do Maurice and Phyllis Paykel Trust e da Auckland Medical Research Foundation (1117015). A direção da IDR é apoiada pela Fundação de Caridade Buchanan. A bolsa de estudos da CK é fornecida pela Associação neozelandesa de Fundos de Pesquisa e Educação de Optometristas (CC36812) e a bolsa de estudos da HHL é fornecida pela Fundação de Caridade Buchanan.
Materials
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors – Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe’s Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe’s Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).

