Karakterisering af en ny human organotypic retinal kultur teknik
Summary
Denne undersøgelse har til formål at udvikle en ny human organotypic retinal kultur (HORC) model, der forhindrer kompromittere retinal integritet under explant håndtering. Dette opnås ved at dyrke nethinden med den overliggende glaslegeme og det underliggende retinale pigment epitel-choroid (RPE-choroid) og sclera.
Abstract
Tidligere humane organotypic retinal kultur (HORC) modeller har udnyttet løsrevne nethinder; men uden den strukturelle støtte, som retinale pigment epitel-choroid (RPE-choroid) og sclera, integriteten af den skrøbelige nethinden let kan kompromitteres. Formålet med denne undersøgelse var at udvikle en ny HORC model, der indeholder nethinden, RPE-choroid og sclera at opretholde retinal integritet, når dyrkning retinale explants.
Efter at have skåret omkredsligt langs limbus for at fjerne iris og linse, fire dybe snit blev foretaget for at flade øjet. I modsætning til tidligere HORC protokoller, en trephin blev brugt til at skære igennem ikke kun nethinden, men også RPE-choroid og sclera. De resulterende triple-lag explants blev kultiveret i 72 timer. Hæmatoxylin og Eosin farvning (H&E) blev brugt til at vurdere anatomiske strukturer og retinale explants var yderligere karakteriseret ved immunohistochemistry (IHC) for apoptose, Müller celle integritet og retinal betændelse. For at bekræfte muligheden for sygdom induktion, explants blev udsat for høj glukose (HG) og pro-inflammatoriske cytokiner (Cyt), at efterligne diabetisk retinopati (DR). Luminex magnetiske perle assay blev brugt til at måle DR-relaterede cytokiner frigivet i kulturmediet.
H &E farvning afslørede forskellige retinale lameller og kompakte kerner i retinale explants med den underliggende RPE-choroid og sclera, mens nethinder uden de underliggende strukturer udviste reduceret tykkelse og alvorlige kerner tab. IHC-resultater indikerede fravær af apoptose og retinal inflammation samt bevaret Müller celleintegritet. Luminex-analyserne viste signifikant øget udskillelse af DR-associerede proinflammatoriske cytokiner i retinale explants, der blev eksponeret for HG + Cyt i forhold til baselineniveauer ved 24 timer.
Vi har med succes udviklet og karakteriseret en ny HORC-protokol, hvor retinal integritet blev bevaret uden apoptose eller retinal betændelse. Desuden tyder den inducerede udskillelse af DR-associerede proinflammatoriske biomarkører, når de udsætter retinale explants for HG + Cyt, at denne model kan bruges til klinisk oversættelige retinale sygdomsundersøgelser.
Introduction
Nethinden er en højt specialiseret okulær struktur, der er ansvarlig for at omdanne indgående lysenergi til elektriske signaler, som derefter behandles af hjernen for visuel opfattelse. Den menneskelige nethinde indeholder et dynamisk område af celletyper, velorganiseret i en unik lamellar struktur bestående af to synaptiske og tre kerner lag1 (Figur 1). Retinal homøostase opretholdes af de indviklede forbindelser mellem neuroretinale celler, blodkar, nerver, bindevæv og RPE1. På grund af den sofistikerede retinale anatomi og fysiologi forbliver mekanismer af mange retinale sygdomme stadig dårligt forstået2,3,4,5. For bedre at kunne studere retinale sygdomme er HORC-modeller udviklet6,7,8,9. Sammenlignet med dyreforsøg og in vitro-kulturer er HORC-modeller fordelagtige, fordi de bevarer det dynamiske cellulære miljø og komplekse neurovaskulære interaktioner in situ, hvilket giver en god model til klinisk oversættelse.
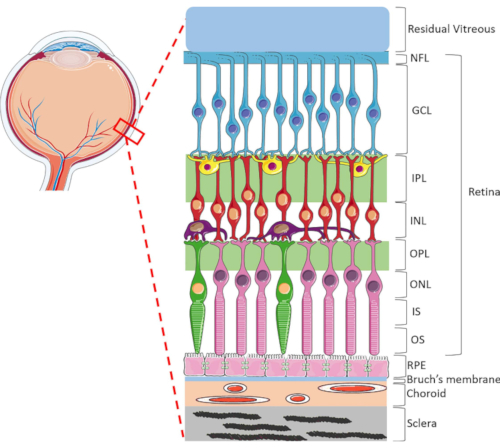
Figur 1: Bageste okulære strukturer i det menneskelige øje. Forreste til posterior, retinale lag er: nerve fiber lag (NFL), ganglion cellelag (GCL), indre plexiform lag (IPL), indre nukleare lag (INL), ydre plexiform lag (OPL), ydre nukleare lag (ONL), fotoreceptor indre segment (IS), og photoreceptor ydre lag (OS). Celler i nethinden omfatter ganglion celler (blå), amakrine celler (gul), bipolare celler (rød), vandrette celler (lilla), stang photoreceptorer (pink) og kegle fotoreceptorer (grøn). Glaslegemet er placeret forreste til nethinden. RPE, Bruchs membran, choroid og sclera er placeret posterior til nethinden. Bemærk, at det viste billede kun er en skematisk repræsentation af nethinden, og forholdet mellem celler/retinale tilslutningsmuligheder inden for hvert lag er muligvis ikke tegn på in vivo-indstillingen. Klik her for at se en større version af dette tal.
Tidligere karakteriseret HORC protokoller6,7,8,9 har involveret adskille nethinden fra den underliggende RPE-choroid og sclera ved hjælp af en kirurgisk trephin. Men uden den støtte, som disse underliggende strukturer, den gennemskinnelige nethinde bliver spinkel, vanskeligt at håndtere og værktøjer såsom sammenkramper kan nemt forstyrre dens integritet. Desuden har isolerende nethinden i kultur uden RPE vist sig at forårsage ganglion celle apoptose og fotoreceptor degeneration10,11,12. Således ville en alternativ HORC-protokol, der minimerer tabet af retinal integritet og bedre efterligner in vivo-miljøet, være nyttig. Dette er især vigtigt, når man studerer retinale sygdomsmekanismer, da fysisk skade under explanthåndtering kan introducere artefakter. Derfor var formålet med denne undersøgelse at udvikle en ny HORC-model, der omfatter RPE-choroid og sclera for at beskytte retinal integritet under explanthåndtering og kultur.
For at nå dette mål blev retinale explants “klemt” mellem de resterende glaslegemer og den underliggende RPE-choroid og sclera ekstraheret. I sandwich explants, glaslegeme vejer ned nethinden for at forhindre nethinde løsrivelse og foldning, mens den hårde, fibrøse sclera fungerer som både et stillads for strukturel støtte og et kontaktpunkt for sammentøvler. Desuden har dyremodeller vist, at bevare RPE i kultur kan forhindre retinal degeneration og glial spredning, en reaktion af Müller celler til faresignaler såsom hypoxi og betændelse10,11,12.
For at karakterisere modellen blev der udført sandwich retinale explants med Hematoxylin og Eosin (H&E) for at vurdere anatomiske strukturer og immunohistochemistry (IHC), mærkning af explants med terminal deoxynukleotidyl transferase dUTP nick end mærkning (TUNEL, en apoptotisk cellemarkør), glial fibrillalsyresyreprotein (GFAP, en retinal betændelse og Müller celleaktiveringsmarkør) og vimentin, en markør for Müller celleintegritet. For at afgøre, om denne model kan induceres til at udvikle molekylære sygdomstegn, blev explants udsat for høj glukose (HG) med proinflammatoriske cytokiner (Cyt), interleukin-1β (IL-1β) og tumornekrosefaktor-α (TNF-α), et kulterende miljø, der har vist sig at efterligne diabetisk retinopati (DR) i både celle- og dyresygdomsmodeller13,14,15. Luminex-analyser blev anvendt i DR-modellen til at måle cytokiner, der blev frigivet til kulturmediet.
Protocol
Representative Results
Discussion
HORC er i øjeblikket den mest klinisk oversættelige model i præklinisk retinal forskning. Sammenlignet med in vitro celle kultur modeller, horc kan bedre repræsentere anatomien af den menneskelige nethinden in situ, ved at bevare de dynamiske retinale celletyper og deres forbindelser med neuroner, vasulater og ekstracellulære miljø19. Sammenlignet med dyremodeller er HORC mere fordelagtige i at studere patofysiologien af og designe farmaceutiske behandlinger for humane retinale sygdomme på …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil gerne takke de generøse donorer af øjenvæv og holdet fra New Zealand National Eye Bank for deres støtte. Dette arbejde blev økonomisk støttet af projekttilskud fra Maurice og Phyllis Paykel Trust og Auckland Medical Research Foundation (1117015). IDR’s bestyrelsespost er støttet af Buchanan Charitable Foundation. CK’s stipendium er leveret af New Zealand Association of Optometrists Education and Research Fund (CC36812) og HHL’s stipendium er leveret af Buchanan Charitable Foundation.
Materials
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors – Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe’s Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe’s Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).

