Karakterisering van een nieuwe menselijke organotypische retinale cultuurtechniek
Summary
Deze studie heeft tot doel een nieuw humaan organotypisch retinale cultuurmodel (HORC) te ontwikkelen dat voorkomt dat de retinale integriteit tijdens explantbehandeling in gevaar komt. Dit wordt bereikt door het netvlies te kweken met het bovenliggende glasvocht en het onderliggende retinale pigmentepitheel-vaatvlies (RPE-vaatvlies) en sclera.
Abstract
Eerdere menselijke organotypische retinale cultuur (HORC) modellen hebben gebruik gemaakt van losse netvliezen; zonder de structurele ondersteuning die wordt verleend door retinale pigmentepitheel-vaatvlies (RPE-vaatvlies) en sclera, kan de integriteit van het fragiele netvlies gemakkelijk worden aangetast. Het doel van deze studie was om een nieuw HORC-model te ontwikkelen dat het netvlies, RPE-vaatvlies en sclera bevat om de retinale integriteit te behouden bij het kweken van retinale explantaten.
Na het snijden omcirkelend langs de limbus om iris en lens te verwijderen, werden vier diepe incisies gemaakt om de oogschelp plat te maken. In tegenstelling tot eerdere HORC-protocollen werd een trephine gebruikt om niet alleen het netvlies door te snijden, maar ook het RPE-vaatvlies en sclera. De resulterende drielaagse explantaten werden gedurende 72 uur gekweekt. Hematoxyline en Eosine-kleuring (H&E) werd gebruikt om anatomische structuren te beoordelen en retinale explantaten werden verder gekenmerkt door immunohistochemie (IHC) voor apoptose, Müller-celintegriteit en retinale ontsteking. Om de mogelijkheid van ziekte-inductie te bevestigen, werden explantaten blootgesteld aan hoge glucose (HG) en pro-inflammatoire cytokines (Cyt), om diabetische retinopathie (DR) na te bootsen. De Luminex magnetische kraaltest werd gebruikt om DR-gerelateerde cytokines te meten die vrijkomen in het kweekmedium.
H&E-kleuring onthulde verschillende retinale lamellen en compacte kernen in retinale explantaten met het onderliggende RPE-vaatvlies en sclera, terwijl netvliezen zonder de onderliggende structuren een verminderde dikte en ernstig kernverlies vertoonden. IHC-resultaten wezen op afwezigheid van apoptose en retinale ontsteking, evenals behoud van Müller-celintegriteit. De Luminex-assays toonden een significant verhoogde secretie van DR-geassocieerde pro-inflammatoire cytokines in retinale explantaten blootgesteld aan HG + Cyt ten opzichte van baseline niveaus na 24 uur.
We hebben met succes een nieuw HORC-protocol ontwikkeld en gekarakteriseerd waarin de retinale integriteit werd bewaard zonder apoptose of retinale ontsteking. Bovendien suggereert de geïnduceerde secretie van DR-geassocieerde pro-inflammatoire biomarkers bij blootstelling van retinale explantaten aan HG + Cyt dat dit model kan worden gebruikt voor klinisch vertaalbare retinale ziektestudies.
Introduction
Het netvlies is een zeer gespecialiseerde oculaire structuur die verantwoordelijk is voor het transformeren van inkomende lichtenergie naar elektrische signalen, die vervolgens door de hersenen worden verwerkt voor visuele waarneming. Het menselijk netvlies bevat een dynamisch bereik van celtypen, sterk georganiseerd in een unieke lamellaire structuur bestaande uit twee synaptische en drie kernlagen1 (Figuur 1). Retinale homeostase wordt ondersteund door de ingewikkelde verbindingen tussen neuroretinale cellen, bloedvaten, zenuwen, bindweefsels en de RPE1. Vanwege de geavanceerde retinale anatomie en fysiologie blijven de mechanismen van veel netvliesaandoeningen nog steeds slecht begrepen2,3,4,5. Om netvliesaandoeningen beter te bestuderen, zijn HORC-modellen ontwikkeld6,7,8,9. In vergelijking met dierstudies en in vitro culturen zijn HORC-modellen voordelig omdat ze de dynamische cellulaire omgeving en complexe neurovasculaire interacties in situ behouden, wat een goed model biedt voor klinische translatie.
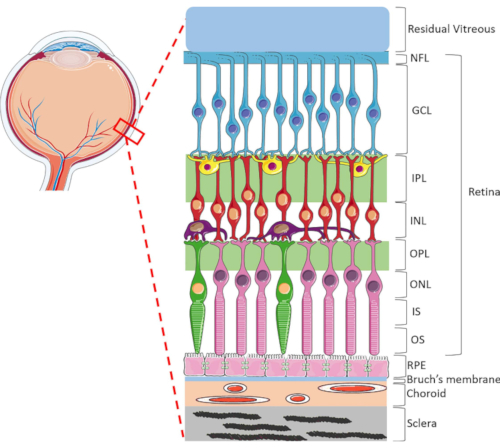
Figuur 1: Posterieure oculaire structuren van het menselijk oog. De retinale lagen van voor naar achteren zijn: zenuwvezellaag (NFL), ganglioncellaag (GCL), binnenste plexiforme laag (IPL), binnenste nucleaire laag (INL), buitenste plexiforme laag (OPL), buitenste nucleaire laag (ONL), fotoreceptor binnenste segment (IS) en fotoreceptor buitenste laag (OS). Cellen in het netvlies omvatten ganglioncellen (blauw), amacrinecellen (geel), bipolaire cellen (rood), horizontale cellen (paars), staaffotoreceptoren (roze) en kegelfotoreceptoren (groen). Het glasvocht bevindt zich anterieur aan het netvlies. De RPE, bruch’s membraan, vaatvlies en sclera bevinden zich achter het netvlies. Merk op dat de getoonde afbeelding slechts een schematische weergave is van het netvlies en dat de verhouding tussen cellen en retinale connectiviteit binnen elke laag mogelijk niet indicatief is voor de in vivo setting. Klik hier om een grotere versie van deze figuur te bekijken.
Eerder gekarakteriseerde HORC-protocollen6,7,8,9 hebben betrekking op het scheiden van het netvlies van het onderliggende RPE-vaatvlies en sclera met behulp van een chirurgische trephine. Zonder de ondersteuning van deze onderliggende structuren wordt het doorschijnende netvlies echter dun, moeilijk te hanteren en kunnen hulpmiddelen zoals een tang de integriteit ervan gemakkelijk verstoren. Bovendien is aangetoond dat het isoleren van het netvlies in cultuur zonder de RPE ganglioncelapoptose en fotoreceptordegeneratie10,11,12veroorzaakt. Een alternatief HORC-protocol dat het verlies van retinale integriteit minimaliseert en de in vivo omgeving beter nabootst, zou dus nuttig zijn. Dit is vooral belangrijk bij het bestuderen van retinale ziektemechanismen, omdat lichamelijk letsel tijdens explantbehandeling artefacten kan introduceren. Daarom was het doel van deze studie om een nieuw HORC-model te ontwikkelen dat het RPE-vaatvlies en sclera omvat om de retinale integriteit te beschermen tijdens explantbehandeling en kweek.
Om dit doel te bereiken, werden retinale explantaten “ingeklemd” tussen het resterende glasvocht en het onderliggende RPE-vaatvlies en sclera geëxtraheerd. In de sandwich explanteert het glasvocht het netvlies om netvliesloslating en vouwen te voorkomen, terwijl de taaie, vezelige sclera fungeert als zowel een steiger voor structurele ondersteuning als een contactpunt voor een tang. Bovendien hebben diermodellen aangetoond dat het behouden van de RPE in cultuur retinale degeneratie en gliale proliferatie kan voorkomen, een reactie van Müller-cellen op gevaarsignalen zoals hypoxie en ontsteking10,11,12.
Om het model te karakteriseren, werden sandwich retinale explantaten gekleurd met Hematoxyline en Eosine (H & E) om anatomische structuren te beoordelen en immunohistochemie (IHC) werd uitgevoerd, waarbij explantaten werden gelabeld met terminale deoxynucleotidyltransferase dUTP nick end labeling (TUNEL, een apoptotische celmarker), glial fibrillair zuur eiwit (GFAP, een retinale ontsteking en Müller-celactiveringsmarker) en vimentine, een marker van Müller-celintegriteit. Om te bepalen of dit model kan worden geïnduceerd om moleculaire ziekteverschijnselen te ontwikkelen, werden de explantaten blootgesteld aan hoge glucose (HG) met pro-inflammatoire cytokines (Cyt), interleukine-1β (IL-1β) en tumornecrosefactor-α (TNF-α), een kweekomgeving waarvan is aangetoond dat deze diabetische retinopathie (DR) nabootst in zowel cel- als dierziektemodellen13,14,15. Luminex-assays werden gebruikt in het DR-model om cytokines te meten die vrijkomen in het kweekmedium.
Protocol
Representative Results
Discussion
HORC is momenteel het meest klinisch vertaalbare model in preklinisch retinaal onderzoek. In vergelijking met in vitro celkweekmodellen kan HORC de anatomie van het menselijk netvlies in situ beter weergeven, door de dynamische retinale celtypen en hun verbindingen met neuronen, vasculaturen en de extracellulaire omgeving te behouden19. In vergelijking met diermodellen is HORC voordeliger bij het bestuderen van de pathofysiologie van en het ontwerpen van farmaceutische behandelingen voor menselijk…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De auteurs willen de gulle gevers van oogweefsels en het team van de Nieuw-Zeelandse National Eye Bank bedanken voor hun steun. Dit werk werd financieel ondersteund door projectsubsidies van de Maurice and Phyllis Paykel Trust en de Auckland Medical Research Foundation (1117015). Het directeurschap van IDR wordt ondersteund door de Buchanan Charitable Foundation. De beurs van CK wordt verstrekt door de New Zealand Association of Optometrists Education and Research Fund (CC36812) en de beurs van HHL wordt verstrekt door de Buchanan Charitable Foundation.
Materials
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors – Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe’s Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe’s Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).

