소설 인간 오르가노피 망막 문화 기술의 특성화
Summary
이 연구는 절제 처리 중 망막 무결성을 손상시키는 것을 방지하는 새로운 인간 organotypic 망막 문화 (HORC) 모형을 개발하는 것을 목표로 합니다. 이것은 과대 유리체와 근본적인 망막 안료 상피 코로이드 (RPE-choroid) 및 clera로 망막을 배양해서 달성됩니다.
Abstract
이전 인간 organotypic 망막 문화 (HORC) 모델은 분리 된 망막을 활용; 그러나 망막 색소 상피-코로이드(RPE-choroid) 및 스클레라에 의해 부여된 구조적 지지없이 연약한 망막의 무결성은 쉽게 손상될 수 있다. 이 연구의 목적은 망막, RPE-choroid 및 clera가 함유 된 새로운 HORC 모델을 개발하여 망막 퇴치를 배양 할 때 망막 무결성을 유지하는 것이었습니다.
홍채와 렌즈를 제거하기 위해 림두를 따라 둘레로 절단 한 후, 4 개의 깊은 절개는 안컵을 평평하게하기 위해 만들어졌다. 이전 HORC 프로토콜과는 달리, 트레핀은 망막뿐만 아니라 RPE-choroid 및 clera를 통해 절단하는 데 사용되었다. 결과 삼중층 이절은 72시간 동안 배양되었다. 헤마톡시린과 에오신 염색(H&E)은 해부학적 구조와 망막 박출을 평가하는 데 사용되었고, 세포 무결성 및 망막 염증을 위한 면역 조직화학(IHC)을 더욱 특징으로 하였다. 질병 유도의 가능성을 확인하기 위해, 이질은 당뇨병 성 망막병증 (DR)을 모방하기 위해 높은 포도당 (HG) 및 프로 염증 성 사이토카인 (Cyt)에 노출되었다. 루미넥스 자기 비드 분석은 배양 배지로 방출된 DR 관련 사이토카인을 측정하는 데 사용되었습니다.
H&E 염색은 기본 RPE-choroid 및 clera와 망막 에 있는 뚜렷한 망막 라멜라 및 소형 핵을 드러내고, 근본적인 구조물이 없는 망막은 감소된 두께 및 가혹한 핵 손실을 나타내었다. IHC 결과는 세포 질과 망막 염증의 부재뿐만 아니라 보존 뮐러 세포 무결성을 나타냈다. Luminex assays는 24시간 기준수준에 비해 HG + Cyt에 노출된 망막 이식에서 DR-관련 프로 염증 성 사이토카인의 분비를 현저히 증가시켰습니다.
우리는 성공적으로 개발 하 고 망막 무결성 세포사멸 또는 망막 염증 없이 보존 하는 새로운 HORC 프로토콜을 특징으로. 더욱이, HG + Cyt에 망막 이질을 노출할 때 DR 관련 프로 염증성 바이오마커의 유도된 분비는 이 모형이 임상적으로 전도성 망막 질병 연구 결과에 사용될 수 있었다는 것을 건의합니다.
Introduction
망막은 들어오는 빛 에너지를 전기 신호로 변환하는 고도로 전문화된 안구 구조로, 이는 시각적 지각을 위해 뇌에 의해 처리됩니다. 인간 망막은 2개의 시냅스와 3개의 핵층1(도 1)으로 구성된 독특한 라멜라구조로 고도로 조직된 세포 모형의 다이나믹 범위를 포함합니다. 망막 항상성 신경 망막 세포 사이 복잡 한 연결에 의해 유지, 혈관, 신경, 결합 조직 및 RPE1. 정교한 망막 해부학 및 생리학으로 인해 많은 망막 질환의 메커니즘은 여전히2,3,4,5로제대로 이해되지 않습니다. 망막 질환을 더 잘 연구하기 위해 HORC 모델은6,7,8,9로개발되었습니다. 동물 연구 와 체 외 배양에 비해, HORC 모델은 동적 세포 환경과 장소에서 복잡 한 신경 혈관 상호 작용을 유지 하기 때문에 유리, 임상 번역에 대 한 좋은 모델을 제공.
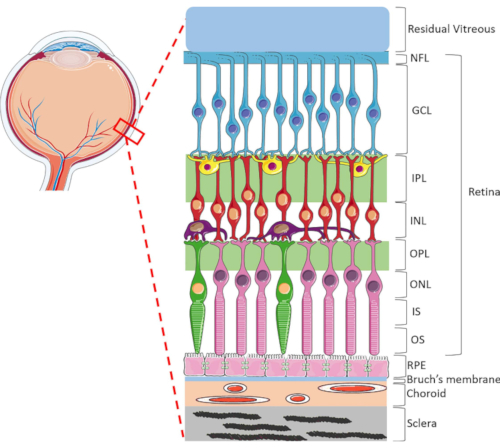
그림 1: 인간의 눈의 후방 안구 구조. 후방에 전방, 망막 층은 다음과 같습니다: 신경 섬유 층 (NFL), 신경절 세포 층 (GCL), 내부 플렉시폼 층 (IPL), 내부 핵 층 (INL), 외부 플렉시폼 층 (OPL), 외부 핵 층 (ONL), 광수용체 내부 세그먼트 (IS), 및 광수용체 외부 층 (OS). 망막 내의 세포는 신경절 세포 (파란색), 막시음 세포 (노란색), 양극성 세포 (빨간색), 수평 세포 (보라색), 막대 광수용체 (분홍색) 및 콘 광수용체 (녹색)를 포함한다. 유리체는 망막에 앞쪽에 위치하고 있습니다. RPE, 브루흐의 막, 코로이드 및 clera는 망막의 후방에 위치하고 있습니다. 표시된 이미지는 망막의 회로도 표현일 뿐이며 각 층 내의 세포/망막 연결의 비율은 생체 내 설정을 나타내지 않을 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이전에 특징지어진 HORC 프로토콜6,7,8,9는 외과 트레핀을 사용하여 기본 RPE-choroid 및 clera로부터 망막을 분리하는 것을 관련시켰습니다. 그러나 이러한 기본 구조에 의해 제공되는 지원없이, 반투명 망막은 어설프게되고, 처리하기 어렵고 집게와 같은 도구는 쉽게 무결성을 방해 할 수 있습니다. 더욱이, RPE 없이 배양에서 망막을 분리하는 것은 신경절 세포 세포 멸각증 및 광수용체 변성을 유발하는 것으로 나타났다10,11,12. 따라서 망막 무결성의 손실을 최소화하고 생체 내 환경을 더 잘 모방하는 대체 HORC 프로토콜이 유용할 것입니다. 이것은 사지 병 기계장치를 공부할 때 특히 중요합니다, 절제 처리 도중 물리적 상해는 유물을 소개할 수 있기 때문에. 따라서, 이 연구의 목적은 퇴치 처리 및 문화 동안 망막 무결성을 보호하기 위해 RPE-choroid 및 clera를 포함하는 새로운 HORC 모델을 개발하는 것이었습니다.
이러한 목표를 달성하기 위해 잔류 유리체와 기본 RPE-choroid 및 clera 사이에 망막 이출이 “끼워”추출되었습니다. 샌드위치 이병대에서 유리체는 망막 분리 및 접이식을 방지하기 위해 망막 아래로 무게가 있는 반면, 터프하고 섬유질 적인 스클레라는 구조적 지지와 집게의 접점 역할을 합니다. 더욱이, 동물 모델은 배양에서 RPE를 유지하는 것이 망막 변성 및 신경교 증식을 방지할 수 있음을 보여주었으며, 저산소증 및염증(10,11,12)과같은 위험 신호에 뮐러 세포의 반응이다.
모델을 특성화하기 위해, 샌드위치 망막 축출은 헤마톡실린과 에오신(H&E)으로 염색되어 해부학적 구조및 면역조직화학(IHC)을 평가하였다. 말기 탈옥뉴클레오디딜 트랜스포메이션 dUTP 닉 엔드 라벨링(TUNEL, 아팝토틱 세포 마커), 글리아 피브릴레산성 단백질(GFAP, 망막 염증 및 뮐러 세포 활성화 마커), 뮐러 세포 무결성의 마커인 비멘틴을 함유한 라벨링. 이 모델이 분자 질환 징후를 개발하도록 유도될 수 있는지 여부를 결정하기 위해, 이 세포는 항염증성 사이토카인(Cyt), 인터류킨-1β(IL-1β) 및 종양 괴사 인자-α(TNF-α)를 가진 고혈당(HG)에 노출되었다, 당뇨병 성 망막증(DR)을 모방한 배양환경, 15세포 모두에서 당뇨병 성 망막증(DR)을 모방한배양환경,13. 루미넥스 아사약은 DR 모델에 사용되어 배양 배지로 방출되는 사이토카인을 측정하였다.
Protocol
Representative Results
Discussion
HORC는 현재 전임상 망막 연구에서 가장 임상적으로 번역 가능한 모델입니다. 시험관 내 세포 배양 모델에 비해, HORC는 동적 망막 세포 유형과 뉴런, 혈관 및 세포 외 환경과의 연결을 유지하여 그 자체에서 인간의 망막의 해부학을 더 잘 나타낼 수 있다19. 동물 모델에 비해 HORC는 동물모델(19)에서긍정적인 결과에도 불구하고 실패한 임상 시험에 기여할 수 있는 ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
저자는 눈 조직의 관대 한 기부자와 뉴질랜드 국립 안과 은행의 팀에게 그들의 지원에 감사드립니다. 이 작품은 모리스와 필리스 페이켈 트러스트와 오클랜드 의학 연구 재단 (1117015)의 프로젝트 보조금에 의해 재정적으로 지원되었다. IDR의 이사직은 부캐넌 자선 재단의 지원을 받고 있습니다. CK의 장학금은 뉴질랜드 검안사 교육 연구 기금(CC36812)에서 제공하며, HHL의 장학금은 부캐넌 자선 재단에서 제공합니다.
Materials
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors – Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe’s Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe’s Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).

