Un capteur basé aptamère pour non chélaté Gadolinium (III)
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 – 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
L'importance croissante de l' imagerie par résonance magnétique (IRM) dans le diagnostic clinique, qui est limitée par la sensibilité inhérente de la technique, a entraîné la croissance rapide de la recherche dans le développement de nouveaux agents de contraste à base de gadolinium (GBCAs) 1. GBCAs sont des molécules qui sont administrés pour améliorer la qualité de l' image, et ils ont généralement la structure chimique d'un ion trivalent de gadolinium (Gd 3+) coordonné à un ligand polydenté. Cette complexation est d' une importance critique que non chélaté Gd 3+ est toxique; elle a été impliquée dans le développement d' une fibrose néphrogénique systémique chez certains patients souffrant d'une maladie rénale ou une insuffisance 2. Par conséquent, la détection de l'ion libre aqueuse contribue à assurer la sécurité des GBCAs. La présence de non chélaté Gd 3+ dans des solutions GBCA est souvent le résultat d'une réaction incomplète entre le ligand et l'ion, la dissociation du complexe, ou déplacement par d' autres cations métalliques biologiques 3.
Parmi les différentes techniques actuellement utilisées pour déterminer la présence de Gd 3+, ceux qui comptent sur la chromatographie et / ou spectrométrie de rang le plus élevé en termes de polyvalence et l' applicabilité 4. Parmi les points forts sont une grande sensibilité et la précision, la capacité d'analyser différentes matrices d'échantillons (y compris le sérum humain 5, l' urine et les cheveux 6, les eaux usées 7, et des formulations d'agent de contraste 8), et la quantification simultanée de plusieurs 3+ complexes Gd (une liste des études avant 2013 est décrite dans un examen complet par Telgmann et al.) 4. Le seul inconvénient est que plusieurs de ces méthodes nécessitent instrumentations (telles que la spectrométrie de masse à plasma à couplage inductif) 4 que certains laboratoires ne peuvent pas avoir accès. Dans le contexte de nouvelle découverte GBCA à la recherche et les niveaux de preuve de concept, arProcédé basé spectroscopique-elatively plus commode, rapide et économique (par exemple, l'absorption UV-visible ou de fluorescence) peut servir comme une alternative intéressante. Avec ces applications à l' esprit, un capteur à base d'aptamères-fluorescent pour aqueuse Gd 3+ a été développé 9.
L'aptamère (Gd-aptamère) est une longue molécule d'ADN simple brin 44-base avec une séquence spécifique de bases qui a été isolé à travers le processus d'évolution systématique de ligands par enrichissement exponentiel (SELEX) 9. Afin d' adapter l'aptamère dans un capteur fluorescent, un fluorophore est attaché à l'extrémité 5 'du brin, qui est ensuite hybridée avec un brin de trempe (QS) par l' intermédiaire de 13 bases complémentaires (figure 1). QS est marquée avec une molécule de désactivateur noir à l'extrémité terminale 3 '. En l'absence de Gd 3+, le capteur (Gd-capteur), composé d'un rapport 1: Gd-aptamère et QS taupe 2 respectivement, auront un minimum d' émission de fluorescence due to le transfert d'énergie à partir du fluorophore à l'agent de neutralisation. L'addition d' une solution aqueuse Gd 3+ va déplacer le QS à partir du Gd-aptamère, ce qui entraîne une augmentation de l' émission de fluorescence.
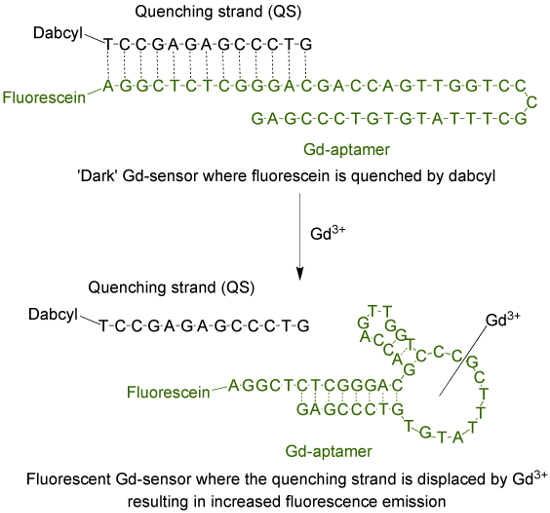
Figure 1. Le capteur (Gd-capteur) qui se compose de l'aptamère 44-base longue (Gd-aptamère) marqué avec de la fluorescéine (un fluorophore) et le 13-base à long trempe brin (QS) marqués avec dabcyl (un quencher foncé) . En l'absence de Gd3 + non chélaté, la fluorescence de la sonde est minime. Avec addition de Gd 3+, le déplacement du QS se produit et une augmentation de l' émission de fluorescence est observée. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Il est à l'heure actuelle, une méthode basée sur spectroscopique communément utilisé pour détectertion aqueuse 3+ Gd. Cet essai utilise la molécule xylénol orange, qui subit un changement de la longueur d' onde d'absorption maximale de 433 à 573 nm lors de la chélation de l'ion 10. Le rapport de ces deux maxima d' absorbance peut être utilisée pour quantifier la quantité de non chélaté Gd 3+. Le capteur de l'aptamère est une alternative (peut aussi être complémentaire) pour le dosage xylénol orange, alors que les deux méthodes ont différentes conditions de réaction (telles que le pH et la composition des solutions tampons utilisées), les sélectivités cibles, les plages linéaires de quantification et les modalités de détection 9.
Protocol
Representative Results
Discussion
À l' aide du capteur à base de Gd-aptamère, une augmentation de l' émission de fluorescence qui est proportionnelle à la concentration de Gd3 + non chélaté est observée. Pour minimiser la quantité d'échantillon utilisée, l'essai peut être exécuté dans une microplaque à 384 puits avec un volume d'échantillon total de 45 ul par puits. Dans cette conception, le choix de la fluorescéine (FAM) et dabcyl (Dab) a été principalement basée sur le coût des réactifs; pour modifi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 – 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Name of Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
Riferimenti
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).

