Um sensor baseado em Aptamer para não quelatada gadolínio (III)
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 – 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
A importância crescente das imagens de ressonância magnética (MRI) em diagnóstico clínico, que é limitada pela sensibilidade inerente da técnica, resultou no rápido crescimento de investigação para o desenvolvimento de novos agentes de contraste à base de gadolínio (GBCAs 1). GBCAs são moléculas que são administrados para melhorar a qualidade da imagem, e eles tipicamente têm a estrutura química de um ião trivalente gadolínio (Gd 3+) coordenado a um ligando polidentado. Esta complexação é de importância crítica como D'us não quelatada 3+ é tóxico; tem sido implicado no desenvolvimento de fibrose sistémica nefrogénica, em alguns pacientes com doença renal ou falha 2. Consequentemente, a detecção do íon livre aquosa é fundamental para garantir a segurança dos GBCAs. A presença de não quelatada Gd3 + em soluções GBCA é muitas vezes o resultado de uma reacção incompleta entre o ligando e o ião, a dissociação do complexo, ou displacement por outros cátions metálicos biológicos 3.
Entre as várias técnicas usadas atualmente para determinar a presença de D'us 3+, aqueles que dependem de cromatografia e / ou classificação espectrometria mais alto em termos de versatilidade e aplicabilidade 4. Entre as suas vantagens são de alta sensibilidade e precisão, a capacidade de analisar diferentes matrizes de amostras de soro humano (incluindo 5, urina e cabelo 6, 7 de águas residuais, e formulações de agentes de contraste 8), e a quantificação simultânea de múltiplos complexos Gd 3+ (um perfil de estudos antes de 2013 é descrito em uma revisão abrangente por Telgmann et al.) 4. O único inconveniente é que vários destes métodos requerem instrumentação (tais como espectrometria de massa de plasma indutivamente acoplado) 4 que alguns laboratórios não podem ter acesso. Dentro do contexto da nova descoberta GBCA na investigação e níveis prova-de-conceito, ARmétodo baseado em espectroscopia elatively mais conveniente, rápido e de baixo custo (por exemplo, absorção de UV-Vis ou de fluorescência) pode servir como uma alternativa valiosa. Com esses aplicativos em mente, um sensor baseado em aptâmero fluorescente para aquosa Gd3 + foi desenvolvido 9.
O aptâmero (Gd-aptâmero) é uma molécula de ADN de 44 bases de comprimento de cadeia simples com uma sequência específica de bases que foi isolado por meio do processo de evolução sistemática de ligandos por enriquecimento exponencial (SELEX) 9. Para adaptar o aptâmero em um sensor fluorescente, um fluoróforo está ligado ao terminal 5 'da cadeia, que é então hibridado com uma cadeia de têmpera (QS), através de 13 bases complementares (Figura 1). O QS é marcado com uma molécula quencher escuro no terminal 3 '. Na ausência de Gd3 +, o sensor (Gd-sensor), composta de uma mistura 1: 2 proporção molar de Gd-aptâmero e QS respectivamente, terá de emissão de fluorescência mínima devido tO transferência de energia do fluoroforo para o inibidor. A adição de solução aquosa Gd3 + irá deslocar o QS do Gd-aptâmero, resultando num aumento da emissão de fluorescência.
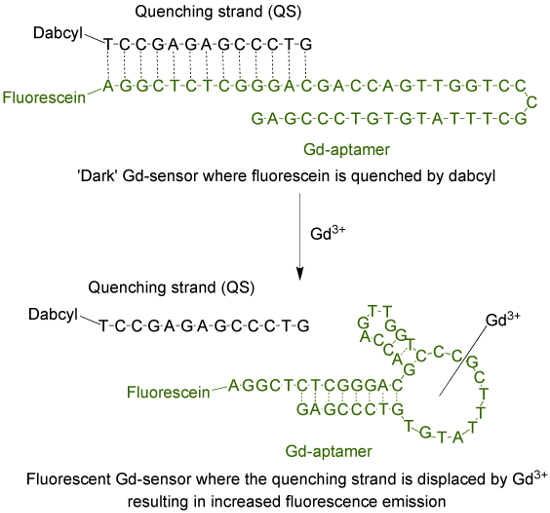
Figura 1. O sensor (Gd-sensor) que consiste no longo aptâmero 44-base (Gd-aptâmero) marcados com fluoresceína (um fluoróforo) e a cadeia de 13 bases de comprimento têmpera (QS) etiquetada com DABCYL (um inibidor escuro) . Na ausência de não quelatada Gd3 +, a fluorescência do sensor é mínima. Com adição de Gd3 +, o deslocamento do QS ocorre e um aumento na emissão de fluorescência é observado. Por favor clique aqui para ver uma versão maior desta figura.
Não existe, actualmente, um método baseado em espectroscopia vulgarmente utilizado para detectaring aquosa 3+ D'us. Este ensaio utiliza o alaranjado de xilenol molécula, que sofre uma mudança no comprimento de onda máximo de absorção 433-573 nm após a quelação com o ião 10. A razão entre estes dois valores máximos de absorvância pode ser usado para quantificar a quantidade de não quelatada Gd3 +. O sensor de aptâmero é uma alternativa (também pode ser complementar) para o ensaio de laranja de xilenol, como os dois métodos têm diferentes condições de reacção (tais como o pH e a composição das soluções tampão utilizadas), selectividades alvo, gamas lineares de quantificação, e as modalidades de detecção 9.
Protocol
Representative Results
Discussion
Usando o Gd-sensor baseado em aptâmero, um aumento na emissão de fluorescência que é proporcional à concentração de não quelatada Gd3 + é observada. Para minimizar a quantidade de amostra utilizada, o ensaio pode ser executado numa microplaca de 384 cavidades com um volume total de amostra de 45 uL por poço. Neste design, a escolha de fluoresceína (FAM) e dabcil (DAB) baseou-se principalmente sobre o custo dos reagentes; para modificar o comprimento de onda de emissão, um emparelhamento diferente …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 – 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Name of Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
Riferimenti
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).

