تصور "ديناميات ليجنيفيكيشن" في النباتات مع "انقر فوق الكيمياء": "وسم المزدوج" هو النعيم!
Summary
وقد وضعت النعيم، بروتوكول وضع العلامات مزدوجة لدراسة ديناميات ليجنيفيكيشن،. استخدام مونوليجنول الاصطناعية الصحفيين ومجموعة متسلسلة من سباك وكواك بيورثوجونال انقر فوق ردود الفعل، وهذه المنهجية يمهد الطريق إلى التحليل المتعمق للعوامل التي تنظم في نشوء حيوي من ليجنينس في بﻻنتا.
Abstract
اللجنين هو أحد البوليمرات البيولوجية الأكثر شيوعاً على هذا الكوكب وعنصرا رئيسيا من الكتلة الحيوية الليجنوسليولوزيه. هذا البوليمر الفينولية تلعب دوراً حيويا في الهيكلية والحمائية في التنمية وفي الحياة من النباتات العليا. على الرغم من أن الآليات المعقدة التي تنظم ليجنيفيكيشن العمليات في فيفو بشدة تأثير تثمين الصناعية للعديد من المنتجات المشتقة من النباتات، المجتمع العلمي لا يزال أمامها طريق طويل للذهاب إلى فك لهم. في سير عمل ثلاث خطوات بسيطة، تمكن بروتوكول وضع العلامات المزدوجة المقدمة في هذه الوثيقة الدراسات بيويماجينج من ليجنيفيينج بنشاط مناطق الأنسجة النباتية. الخطوة الأولى تتمثل في إدراج الأيضية لاثنين من المستقلين الصحفيين الكيميائية، الأمهات البديلات مونوليجنولس الأصلية اثنين التي تؤدي إلى اللجنين وحدات ح وز. بعد دمج في تزايد البوليمرات اللجنين، ثم يسمى كل مراسل على وجه التحديد مع تحقيقاتها الفلورسنت عبر مجموعة متسلسلة من سباك/كواك بيورثوجونال انقر فوق ردود الفعل. جنبا إلى جنب مع أوتوفلوريسسينسي اللجنين، هذا النهج يؤدي إلى توليد خرائط التعريب ألوان من خشبين داخل جدران الخلايا النباتية بالأسفار [كنفوكل] مجهرية ويوفر معلومات مكانية دقيقة على وجود أو عدم وجود نشط ليجنيفيكيشن إليه بمقياس الأنسجة النباتية وخلايا وطبقات مختلفة من جدار الخلية.
Introduction
على مدى العقدين الماضيين، برزت استراتيجية مراسل الكيميائية كمنهجية خطوتين قوية للتحقيق في ديناميات ووظائف الجزيئات الحيوية المشفرة غير وراثيا. 1 , 2 , 3 في هذه الاستراتيجية تناظرية اصطناعية من بيوموليكولي للفائدة مع تعديل صغير – مراسل الكيميائية – يتم أولاً استقلاب بالحي، ومن ثم تحقيق الكيميائي (مثلاً.، فلوروفوري للأسفار تصوير مجهرية [كنفوكل]) يرتبط تساهميا المراسل إدراجها عن طريق الكيمياء انقر فوق بيورثوجونال. أن التحقيق يجب أن تستجيب بسرعة وعلى وجه التحديد مع التعديل الكيميائي أدخلت حين خاملة لأي من الجزيئات الحيوية الموجودة في نظام المعيشة. من نواح عديدة، وهذا الأسلوب يتغلب على القيود المفروضة على تقنيات بيوكونجوجيشن المشتركة من خلال استخدام ليجيشنز الكيمياء انقر محددة للغاية وبالتالي توفير الفرصة لتعقب نواتج الأيض أو بيوماكروموليكوليس التي كانت سابقا غير قابل للوصول في المعيشة نظم4،،من56.
وعلى الرغم من شعبية هذا الأسلوب قوية في الخلايا البكتيرية والحيوانية سريعة النمو، تقارير تصف استخدامه في علم الأحياء النباتية القليلة من المدهش والآن بين7،،من8109،، 11،12. كنا اهتماما خاصا بتطبيق هذه الاستراتيجية في المصانع لدراسة تكوين اللجنين، أحد البوليمرات البيولوجية الأكثر شيوعاً على هذا الكوكب وعنصرا رئيسيا من الكتلة الحيوية الليجنوسليولوزيه. 13 , 14 اللجنين هو بوليمر الفينولية التي تلعب دوراً حيويا في الهيكلية والحمائية في التنمية وفي الحياة من النباتات العليا.
وهو عموما يتألف من ثلاثة 4-هيدروكسيفينيلبروبانويد مويتيس: ح (فهيدروكسيفينيل), G (جاياسيل) ووحدات S (سيرينجيل) على التوالي المستمدة من ثلاثة ‘مونوليجنولس’ (فكوماريل، كونيفيريل، وسينابيل الكحول) التي وتوليفها عبر ممر فينيلبروبانويد في السيتوبلازم للخلية (الشكل 1). تتأكسد بعد تصديرها إلى جدار الخلية، مونوليجنولس إلى الجذور التي بيروكسيداسيس أو لاككاسيس بعد ذلك أنها تمر بتفاعلات كيميائية بحتة اقتران الراديكالية بلمرة للبوليمرات اللجنين، وصف عملية ليجنيفيكيشن. 15 , 16 على الرغم من أن ليجنينس تأثيراً قويا تثمين الصناعية كثير المشتقة من النباتات المنتجات، والمجتمع العلمي لا يزال أمامها طريق طويل للذهاب إلى فك الآليات المعقدة التي تنظم ليجنيفيكيشن.
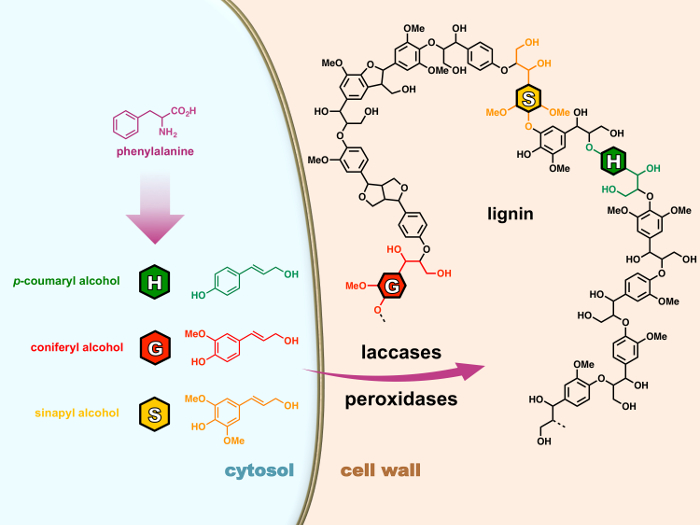
رقم 1: عملية ليجنيفيكيشن في الخلايا النباتية- مونوليجنولس بيوسينثيسيزيد من فينيلألانين في سيتوسول. تتأكسد بعد تصديرها إلى جدار الخلية، مونوليجنولس إلى الجذور التي بيروكسيداسيس أو لاككاسيس بعد ذلك أنها تمر بتفاعلات كيميائية بحتة اقتران الراديكالية بلمرة للبوليمرات اللجنين، وصف عملية ليجنيفيكيشن. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
على الرغم من تقارير عن استخدام ردود الفعل بيورثوجونال لتحليل جليكان العديدة،2،،من317 بهم تطبيق الأمثلة على أنواع أخرى من الجزيئات الحيوية أقل. كان رائدا استخدام الكيمياء بيورثوجونال لأغراض بيويماجينج اللجنين إلا في الآونة الأخيرة من قبل توبيماتسو et al. 8 في نبات التمويل لتوفير معلومات حول إدماج كونيفيريل الأمهات البديلات الكحول إلى البوليمر اللجنين حيث أنها تشكل وحدات ز،،من89 مما يدل على إثبات المبدأ الذي مراسل الكيميائية استراتيجيات قابلة للتطبيق في هذا السياق. استخدام كواك كانت تتجلى أيضا في استخدام مشتق الكحول كونيفيريل مختلفة قليلة في الشهر في وقت لاحق بوكوفسكي وآخرون. 9 ولكن اللجنين يحتوي أيضا على وحدات ح وق وفهم أعمق لعملية ليجنيفيكيشن يتطلب المزيد من المعرفة عن كيفية إدراج كل من مونوليجنولس في البوليمر وما هي العوامل التي يمكن التحكم في تشكيلها. التطورات الجديدة في هذا الميدان يعتمدون حاليا على تطوير منهجيات فعالة لتعقب الصحفيين الكيميائية متعددة في نفس الوقت في الأنظمة الحية. على الرغم من أن بعض المواد في جليكانس قد أرست الأساس في السنوات الأخيرة18،19،20،،من2122، وصف النهج المزدوج يظل تحديا رئيسيا في كيمياء بيورثوجونال. إذا كان بروتوكول انقر فوق تسمية مفردة استنساخه من الصعب تطوير، ثم مزدوج وسم النهج التي تتطلب التحسين في ترادف اثنين بعضها بعضا بيورثوجونال متوافق مع ردود الفعل على اثنين من الصحفيين الكيميائية منفصلة أصعب. تستخدم الأمثلة القليلة التي كانت رائدة في هذا الجانب مزيجاً من سلالة تشجيع أزيد-ألكاين سيكلواديشن (سباك) والطلب الإلكترونية العكسية الكين-تيترازيني ديلز-الدر (داللاستثمارات) ردود الفعل لدراسة جليكانس في الخلايا الحيوانية. ومع ذلك، كنا نظن أن بيورثوجوناليتي من رد فعل داينف قد لا يمكن ضمانها في هذا التطبيق نظراً للسمات الهيكلية من اللجنين (التي تتألف من مونومرات الغنية بالإلكترونات المستبدلة سيناميل-نوع التي يمكن أن تتفاعل مع إلكترون-الفقراء دينيس مثل المجسات تيترازيني المستخدمة في التفاعلات داينف)، وأن هذا قد يولد وسم غير محددة. وبالإضافة إلى ذلك، يتطلب رد فعلللاستثمارات دا مقابض الكيميائية التي يصعب صناعيا بالوصول، فضلا عن كونها ضخمة ومحبتين مما زاد من إمكانية أن معدل التأسيس والنقل و/أو الترجمة للمادة الكيميائية مراسل في فيفو قد تتأثر. كما رأينا أن الجانب الأخير بصفة خاصة في حالة اتباع نهج انقر فوق كيمياء لدراسة ليجنيفيكيشن، اخترنا اتجاه مختلف وتطويرها باستخدام “بيورثوجونال ربط التصوير المتسلسل استراتيجية” (النعيم) مزيج من سيكلواديشن أزيد-ألكاين سترينبروموتيد (سباك) والنحاس حفزت أزيد-ألكاين “سيكلواديشن” (كواك) المجراة في. 23
ردود الفعل هذه اثنين هي في الواقع فوق بيورثوجونال الرئيسية اثنين من ردود الفعل التي استخدمت حتى الآن، وأخص في الأمثلة القليلة من اللجنين التصوير التي نشرت مؤخرا. 8 , 9 استراتيجيتنا التوسيم المزدوج يمكن استخدام moiety أزيد شأن مراسل مونوليجنول واحد والكاين طرفية الأخرى، اثنين من مقابض الكيميائية ط) أونريكتيفي نحو الهياكل ذات الصلة بيولوجيا والثاني) جداً صغيرة الحجم (الشكل 2 ). كنتيجة لذلك، يتم تصغير أثر هذه التعديلات الاصطناعية في الخصائص الفيزيائية بيوموليكولي قيد الدراسة وبالتالي تقليل الاختلافات الممكنة بين ركائز مونوليجنول الطبيعية وغير الطبيعية من حيث النقل و معدلات ميتابوليزيشن أثناء الخطوة إدراج الأيضية. على الرغم من أن الجمع بين سباك وكواك تبدو بديهية جداً للوهلة الأولى، أنها معرفتنا فقط المثال الثاني وسم المزدوج باستخدام هذه الاستراتيجية والتطبيق الأول على هياكل خلاف جليكانس. 12 , 23
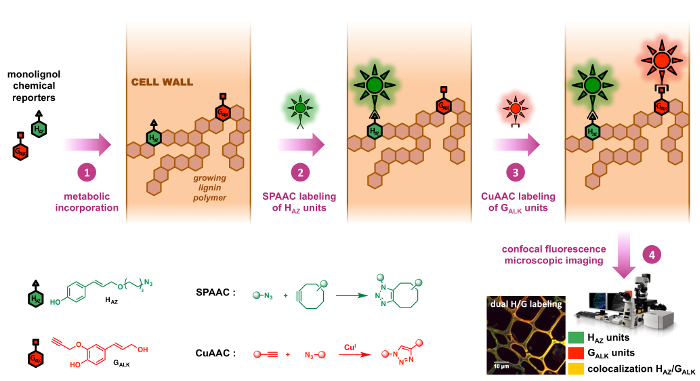
رقم 2: بليس وسم استراتيجية مزدوجة- الكيميائية الصحفيين حمن الألف إلى الياء وزكيه هي النظير المعلمة مونوليجنولس ح وز الأم. أولاً إدماجها في البوليمرات اللجنين المتزايد لجدر الخلايا عن طريق تغذية خارجية (الخطوة 1). سيكلوكتيني-وأزيد-فونكتيوناليزيد المسابير الفلورسنت ثم هي متصلة تسلسلياً للصحفيين مدمجة من بيورثوجونال انقر فوق الكيمياء: رد فعل سباك (الخطوة 2) محددة للغاية لوحدات حمن الألف إلى الياء وتبعتها (رد فعل كواك الخطوة 3) التي محددة لوحدات زكيه (الخطوة 3)، مما يتيح التعريب محددة لكل الصحفيين بشكل مستقل في نفس العينة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
نحن أولاً المصممة والتحقق من صحة مراسل حمونوليجنول معلم أزيدمن الألف إلى الياء (مركب الكحول-كوماريل ف) والسلائف من وحدات اللجنين ح، وثم وضعت استراتيجية التوسيم المزدوج النعيم الذي يتم استخدامه بالتزامن مع وذكرت سابقا معلم ألكاين زكيه،9 (مركب الكحول كونيفيريل) والسلائف من اللجنين ز وحدات. في هذا البروتوكول استنساخه طورت واختبرت في الكتان، ويتحقق من أنواع النباتية هامة اقتصاديا، إدراج الأيضية المزدوج حمن الألف إلى الياء و زكيه في اللجنين أولاً قبل متسلسلة سباك/كواك وضع العلامات. هنا، هي وحداتمن الألف إلى الياء حالمعلمة أولاً المسمى على وجه التحديد عن طريق ربط سباك من فلوروفوري فونكتيوناليزيد سيكلوكتيني، تليها كواك بوساطة ربط التحقيق الفلورسنت الثانية على المعلمة زكيه الوحدات. هذا الأسلوب تم استخدامه للتحقيق في ديناميات العمليات ليجنيفيكيشن داخل جدران الخلايا النباتية ويمكن تطبيقها في فيفو لوقف المقاطع العرضية، تعيش ينبع فضلا عن شتلة من الأنواع النباتية المختلفة.
Protocol
Representative Results
Discussion
كما ذكر آنفا، البروتوكول بليس التوسيم المزدوجة المعروضة في هذه الورقة أحد الأمثلة الأولى تركيبة سباك/كواك في فيفو12،23. كل خطوة كان جيدا الأمثل، والتحقق من صحتها، وأنه من المهم جداً أن يحترم النظام فيها اثنين انقر فوق الكيمياء ردود فعل التوسيم تتم تسلسلياً (أي سباك أولاً، تليها كواك). ضوابط عبر كافة أظهرت أن كل خطوة وصفها محددة عندما يكون البروتوكول بليس التطبيقية23 : القيام بخطوة سباك يؤدي أولاً إلى تشيموسيليكتيفي عالية وسم حمهام أزيدمن الألف إلى الياء فونكتيوناليزيد سيكلوكتيني فلوروفوري من خلال رد فعل [2 3 +] سيكلواديشن مع حركية سريعة. حالما يتم تمييزها وحدات حمن الألف إلى الياء ، يمكن القيام الخطوة كواك مما يستلزم تفعيل زكيه الكينس محطة لتوليد وصلات تريازولي برد فعل مع التحقيق 545 فلور أزيد النحاس الأحادي حفزت. وفي المقابل، بالترتيب العكسي (أي، كواك أولاً، متبوعة سباك) لا ينبغي أن تستخدم كما أنها تؤدي إلى وحدة زكيه وحمن الألف إلى الياء اقتران الصليب، الذي يتنافس مع ربط فلوروفوري ويؤدي إلى خسارة درامية في إشارة . من المهم أيضا التشديد على ضرورة الخطوات الوسيطة الغسيل لتجنب تلطيخ غير محددة.
وقد أظهرنا أن لدينا طريقة يمكن تطبيقها على مختلف التجارب البيولوجية التصاميم. أولاً طبق بليس وسم البروتوكول للمقاطع العرضية مرفوعة من الكتان ينبع (حوالي 150-250 ميكرون سميكة) التي كانت سابقا قص والمحتضنة مع مونوليجنولس انقر فوق استعداد. على الرغم من أن هذا التصميم يتميز بتقليل الكميات اللازمة من مراسل الكيميائية (كما يتم تقليل حجم حاضنات) وتيسير إنتاج replicates الإحصائية، أنها ليست كذلك، صارما في حديثة، نظام في الجسم الحي ، وفي بعض الحالات، قد لا تعكس جميع جوانب الديناميات ليجنيفيكيشن الحقيقي الزمانية. في تصميم تجريبية ثانية، ولذلك نحن تكييف البروتوكول بليس لأسلوب الذي تم استخدامه مسبقاً لدراسة إدراج مونوليجنولس راديولابيليد في الصنوبر والجنكه27. في هذا النهج، جذور وساق النبات تكون مفصولة ماديا وهي المحتضنة قاعدة الجذع كله في حل مونوليجنول بما قد يطلق عليه النهج ‘إناء الزهور’. بعد مغادرة ينبع الوقت المطلوب (الحضانة)، المقاطع العرضية هي قص وبروتوكول النعيم أداء. هذا يسمح لنا بإظهار (ط) أن مونوليجنولس تعديل يتم نقلها عن طريق الجذعية الحية وأدرجت في تزايد البوليمرات اللجنين داخل جدران الخلية و (ثانيا) أن كان نمط التعريب أساسا مطابقاً للمقطع العرضي النهج. يتميز هذا النوع من التجربة المنجزة في مصنع لمعيشة حقيقية/خلية يعيش نهج السماح بتجارب أطول وأكثر الدراسات المتعمقة، ولكن يتطلب كميات أكبر من المواد الكيميائية مراسل. وأخيراً، كان أيضا استخدام البروتوكول النعيم مع شتلات نبات الكتان، تمثل حقيقي يعيش طراز النبات فيها للصحفيين الكيميائية يجب أن تكون يمتص عن طريق الجذور قبل نقلها حتى وقف. بينما هذا النموذج له ميزة واضحة يجري تنفيذها في النباتات الحية، في الممارسة العملية، فإنه يقتصر على شتلات صغار وليس حقاً مناسبة للتحقيق في ديناميات ليجنيفيكيشن في النباتات الأكبر سنا لأسباب عملية (حضانة طويلة الوقت، مرتفعة كمية من الصحفيين الكيميائية). ومع ذلك، هذه التجربة ثلاثة التصاميم متكاملان، وجميعها إيجابيات وسلبيات فيما يتعلق بالجوانب العملية وأهمية بيولوجية تبعاً لنوع السؤال البيولوجية الرد على.
المتقدمة لدراسة ديناميات ليجنيفيكيشن في الكتان، لدينا بروتوكول القدرة على التكيف، ليس فقط من حيث تصميم التجربة البيولوجية، بل أيضا من حيث انطباقه على الآخر زراعة الأنواع وأجهزة/الأنسجة. على سبيل المثال، يمكن بسهولة نقل بليس لنبات أو أجناس حور التي أكثر قابلية للدراسات مع طفرات المغلوب أو تدق لأسفل لجينات مختلفة. من حيث المبدأ، دراسات وضع العلامات المزدوجة مع نهجنا يمكن أيضا توسيع للجزيئات الحيوية الأخرى باستخدام اثنين من السلائف معدلة متميزة البوليمرات جدار الخلية النباتية–بما في ذلك جميع مونوليجنولس الرئيسية الثلاث أو سلائفها الأيضية فضلا عن مختلف السكريات الأحادية التي تشكل مصفوفة السكاريد. منذ نشأتها، الكيمياء بيورثوجونال في الواقع أساسا وضعت للتحقيق في جليكانس/السكريات عن طريق oligosaccharide الأيضية الهندسية (وزارة التربية والتعليم)4،5،،من1728، ولكن من المدهش أن هناك فقط تطبيقات قليلة جداً لزراعة الأحياء حتى الآن7،،من89،10،،من1112. من حيث التوافق من ردود الفعل، وكانت دراسة اللجنين الواقع قضية معقدة لحل كل الصحفيين الكيميائية مدرجة ضمن نفس البوليمر شبكية. إمكانية غير مسمى حمن الألف إلى الياء-تكوين قياسكيه زكان القضية الرئيسية للتغلب على نظراً للقرب المكاني زكيه ووحداتمن الألف إلى الياء حداخل 3D هيكل من اللجنين23، قيد التي قد لا تكون موجودة في حالة عدم إدراج اثنين من الصحفيين الكيميائية في نفس النوع من بيوبوليمير أو في نفس المنطقة المكانية لأي خلية معينة.
على نطاق أوسع يمكن تطبيق المنهجية بليس أساسا لأي دراسة الأسفار اللونين التصوير في النماذج البكتيرية أو الحيوانية باستخدام اثنين من الصحفيين الكيميائية المتميزة آخذا أزيد والعلامة ألكاين الطرفية، على التوالي.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
ونحن مدينون إلى “فرابيو اتحاد البحوث” ومنصة التصوير تيسبيو (جامعة ليل، يزار، الأب 3688، فرابيو، بيوتشيميستروكتورالي et Biomoléculaires فونكتيونيلي des تجمعات) لتوفير البيئة التقنية المؤدية إلى تحقيق هذا العمل.
Materials
| (E)-4-(3-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)prop-1-en-1-yl)phenol (HAZ) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| (E)-4-hydroxy-3-propargyloxycinnamyl alcohol (GALK) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| 2% sodium hypochlorite | |||
| 20 cm high glass tube | |||
| 250 mL Schott glass bottle | |||
| 48-well Plate | |||
| 5/6-TAMRA-PEG3-Azide | Jena Bioscience | CLK-AZ109-1 | |
| Aluminium foil | |||
| Cheese cloth | |||
| Compost containing clay | |||
| Coniferyl alcohol (G) | Sigma Aldrich | MFCD00002922 | |
| Copper (II) sulfate pentahydrate | |||
| DBCO-PEG4-5/6-Carboxyrhodamine 110 | Jena Bioscience | CLK-A127-1 | |
| Milli-Q Ultrapure water | |||
| Eppendorf 1,5 mL | |||
| EtOH | |||
| Flax seeds (L. usitatissimum L.) | |||
| Fluoromount-G™ Slide Mounting Medium | Electron Microscopy Sciences | 17984-25 | |
| Glass coverslip | |||
| Glass microscope slide | |||
| Growth chamber | CLF-Plant Climatics | For 2-week-old plants culture | |
| Growth chamber | Angelantoni Life Sciences | For 2-month-old plants culture | |
| Magenta plant culture box | For 2-week-old seedling culture | ||
| Methanol | Toxic (SGH02, SGH06, SGH08), work with gloves under a hood | ||
| Micropipette | |||
| Nail polish | |||
| Nikon A1R confocal microscope | Nikon | ||
| Orbital shaker | |||
| Parafilm | |||
| p-Coumaryl alcohol (H) | Carbosynth | FC145653 | |
| Plastic cap | |||
| Plastic pipette | |||
| Plastic pot | For 2-month-old plants culture | ||
| Razor blade | |||
| Rubber band | |||
| Sodium Ascorbate | |||
| Sterile clamp | |||
| Vertical support | |||
| Vortex | |||
| Reagents for liquid and solid ½ MS medium | |||
| KH2PO4 | |||
| KNO3 | |||
| NH4NO3 | |||
| MgSO4.7H2O | |||
| CaCl2.2H2O | |||
| MnSO4.H2O | |||
| ZnSO4.7H2O | |||
| H3BO3 | |||
| KI | |||
| Na2MoO4.2H2O | |||
| CuSO4.5H2O | |||
| CoCl2.6H2O | |||
| Na2EDTA.2H2O | |||
| FeSO4.7H2O | |||
| Thiamine.HCl | |||
| Pyridoxine.HCl | |||
| Glycine | |||
| Nicotinic acid | |||
| Myo-inositol | |||
| Saccharose | |||
| MES hydrate | |||
| Agar |
Riferimenti
- Grammel, M., Hang, H. C. Chemical reporters for biological discovery. Nat Chem Biol. 9 (8), 475-484 (2013).
- Prescher, J. A., Bertozzi, C. R. Chemistry in living systems. Nat Chem Biol. 1 (1), 13-21 (2005).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality. Ange Chemie (Int Ed. Engl). 48 (38), 6974-6998 (2009).
- Chang, P. V., et al. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Ange Chemie (Int Ed. Engl). 48 (22), 4030-4033 (2009).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem. Commun. 52 (11), 2318-2321 (2016).
- Mbua, N. E., et al. Abnormal accumulation and recycling of glycoproteins visualized in Niemann-Pick type C cells using the chemical reporter strategy. Proc Natl Acad Sci U S A. 110 (25), 10207-10212 (2013).
- Anderson, C. T., Wallace, I. S., Somerville, C. R. Metabolic click-labeling with a fucose analog reveals pectin delivery, architecture, and dynamics in Arabidopsis cell walls. Proc Natl Acad Sci U S A. 109 (4), 1329-1334 (2012).
- Tobimatsu, Y., et al. A click chemistry strategy for visualization of plant cell wall lignification. Chem. Commun. 50 (82), 12262-12265 (2014).
- Bukowski, N., et al. Development of a clickable designer monolignol for interrogation of lignification in plant cell walls. Bioconjugate Chem. 25 (12), 2189-2196 (2014).
- Pandey, J. L., et al. A versatile click-compatible monolignol probe to study lignin deposition in plant cell walls. PLOS ONE. 10 (4), e0121334 (2015).
- Pandey, J. L., et al. Investigating biochemical and developmental dependencies of lignification with a click-compatible monolignol analog in Arabidopsis thaliana stems. Front Plant Sci. 7, (2016).
- Zhu, Y., Wu, J., Chen, X. Metabolic labeling and imaging of N-linked glycans in Arabidopsis thaliana. Ange Chemie (Int Ed. Engl). 55 (32), 9301-9305 (2016).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annu Rev Plant Biol. 54, 519-546 (2003).
- Weng, J. -. K., Chapple, C. The origin and evolution of lignin biosynthesis. New Phytol. 187 (2), 273-285 (2010).
- Mottiar, Y., Vanholme, R., Boerjan, W., Ralph, J., Mansfield, S. D. Designer lignins: harnessing the plasticity of lignification. Curr Opin Biotechnol. 37, 190-200 (2016).
- Rinaldi, R., et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis. Ange Chemie (Int Ed). 55 (29), 8164-8215 (2016).
- Wratil, P. R., Horstkorte, R., Reutter, W. Metabolic glycoengineering with N-acyl side chain modified mannosamines. Ange Chemie (Int Ed. Engl). 55 (33), 9482-9512 (2016).
- Feng, L., et al. Bifunctional unnatural sialic acids for dual metabolic labeling of cell-surface sialylated glycans. J Am Chem Soc. 135 (25), 9244-9247 (2013).
- Dumont, M., et al. Plant cell wall imaging by metabolic click-mediated labelling of rhamnogalacturonan II using azido 3-deoxy- d – manno -oct-2-ulosonic acid. Plant J. 85 (3), 437-447 (2016).
- Niederwieser, A., et al. Two-color glycan labeling of live cells by a combination of Diels-Alder and click chemistry. Ange Chemie Int Ed. 52 (15), 4265-4268 (2013).
- Späte, A. -. K., et al. Exploring the potential of norbornene-modified mannosamine derivatives for metabolic glycoengineering. Chem Bio Chem. 17 (14), 1374-1383 (2016).
- Späte, A. -. K., et al. Rapid Labeling of metabolically engineered cell-surface glycoconjugates with a carbamate-linked cyclopropene reporter. Bioconjugate Chem. 25 (1), 147-154 (2014).
- Lion, C., et al. BLISS: a bioorthogonal dual-labeling strategy to unravel lignification dynamics in plants. Cell Chem Biol. 24 (3), 326-338 (2017).
- del Río, J. C., et al. Structural characterization of guaiacyl-rich lignins in flax (Linum usitatissimum) fibers and shives. J Agric Food Chemist. 59 (20), 11088-11099 (2011).
- Huis, R., et al. Natural hypolignification is associated with extensive oligolignol accumulation in flax stems. Plant Physiol. 158 (4), 1893-1915 (2012).
- Chantreau, M., et al. Ectopic lignification in the flax lignified bast fiber1 mutant stem is associated with tissue-specific modifications in gene expression and cell wall composition. The Plant Cell. 26 (11), 4462-4482 (2014).
- Terashima, N., Ko, C., Matsushita, Y., Westermark, U. Monolignol glucosides as intermediate compounds in lignin biosynthesis. Revisiting the cell wall lignification and new 13C-tracer experiments with Ginkgo biloba and Magnolia liliiflora. Holzforschung. 70 (9), 801-810 (2016).
- Noel, M., et al. Probing the CMP-sialic acid donor specificity of two human β-d-galactoside sialyltransferases (ST3Gal I and ST6Gal I) selectively acting on O- and N-glycosylproteins. Chembiochem: Eur J Chem Biol. , (2017).

