Lignification Dynamics ile tıklatın kimya tesislerinde görselleştirme: Çift etiketleme BLISS olduğunu!
Summary
BLISS, lignification dinamikleri, eğitim için bir çift etiketleme iletişim kuralı geliştirilmiştir. Sentetik monolignol kullanarak gazetecilere ve SPAAC ve CuAAC bioorthogonal sıralı bir arada tepkiler, bu metodoloji açıyor lignins planta içindeBiyogenez düzenleyen faktörler derinlemesine analiz için yolu tıklatın.
Abstract
Lignin gezegendeki en yaygın biyopolimer ve lignocellulosic biyokütle önemli bir bileşeni biridir. Bu fenolik polimer geliştirme ve hayat daha yüksek bitkilerin önemli bir yapısal ve koruyucu rol oynar. Her ne kadar kuvvetle lignification süreçleri içinde vivo düzenleyen karmaşık mekanizmalar endüstriyel valorization birçok bitki elde edilen ürünlerin etkisi, bilimsel topluluk hala onları deşifre etmek için gitmek için uzun bir yol var. Basit bir üç adım akışında aktif bölgeleri bitki dokuların lignifying bioimaging çalışmaları burada sunulan çift etiketleme iletişim kuralı sağlar. İlk adım iki bağımsız kimyasal gazetecilere, lignin H ve G birimleri ortaya çıkmasına iki yerli monolignols vekilleri metabolik birleşmesiyle oluşur. Lignin polimerler büyüyen içine birleşme sonra her muhabir sonra özellikle kendi floresan sonda bioorthogonal SPAAC/CuAAC tıklayın reaksiyonlar sıralı kombinasyonu ile taşır. Lignin autofluorescence ile birlikte, bu yaklaşım ve lignin bitki hücre duvarları içinde üç renkli yerelleştirme haritaların üretimi confocal floresan mikroskopi tarafından yol açar ve etkin durumunda kesin mekansal bilgi sağlar lignification makine bitki doku, hücre ve farklı hücre duvarı katmanları ölçekte.
Introduction
Son iki yılda, kimyasal muhabir strateji dynamics ve sigara-genetik olarak kodlanmış biomolecules fonksiyonlarını araştırmak için güçlü iki aşamalı metodoloji ortaya çıkmıştır. 1 , 2 , 3 bu strateji küçük modülasyon- kimyasal muhabir -ilgiyle biomolecule sentetik bir analog ilk canlı organizma ve sonra kimyasal bir sonda metabolize (örn., bir fluorophore floresan için confocal mikroskobu görüntüleme) kovalent anonim muhabiri bioorthogonal tıklayın kimya yoluyla bağlanır. Sonda hızla ve özellikle tepki gerekir herhangi bir biomolecules yaşam sistemde, inert olurken tanıtılan kimyasal değişiklik ile. Birçok yönden, bu yöntem çok özel tıklayın kimya d böylece metabolitleri veya önceden ulaşılmaz biomacromolecules izlemek için fırsat sağlayan kullanımı ile ortak bioconjugation teknikleri ile ilgili sınırlamalar üstesinden gelir yaşayan sistemler4,5,6.
Bakteri ve hayvan hücrelerinde güçlü Bu yöntem hızlı büyüyen popülerlik rağmen şaşırtıcı derecede az ve çok7arasında,8,9,10kullanımı bitki Biyoloji açıklayan raporlar, 11,12. Bu strateji lignin, gezegendeki en yaygın biyopolimer biri ve lignocellulosic biyokütle önemli bir bileşeni oluşumu eğitim tesislerinde uygulama özellikle ilgilenmişlerdir. 13 , 14 lignin geliştirme ve hayat daha yüksek bitkilerin önemli bir yapısal ve koruyucu rol oynar Bakalit bir polimerdir.
Genellikle üç 4-hydroxyphenylpropanoid moieties oluşmaktadır: H (p– hydroxyphenyl), G (guaiacyl) ve S (syringyl) birimler sırasıyla üç türetilmiş olan ‘monolignols’ (p– coumaryl, coniferyl ve sinapyl alkoller) (şekil 1) hücrenin sitoplazmada phenylpropanoid yolu üzerinden sentezledim. Hücre duvarı ihraç edilmekte, monolignols okside peroxidases veya laccases sonra onlar kimyasal radikal kaplin tepkiler lignin polimerler için polimerize geçmesi radikaller için bir işlemi olarak lignification. 15 , 16 lignins güçlü birçok bitki kaynaklı sanayi valorization etkisi rağmen ürünler, bilimsel topluluk hala vardır lignification düzenleyen karmaşık mekanizmaları deşifre etmek için gitmek için uzun bir yol.
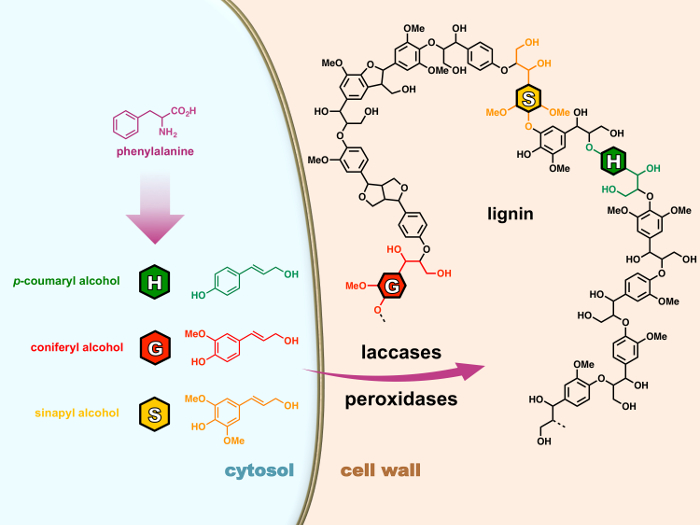
Şekil 1: bitki hücreleri lignification işleminde. Monolignols uzarlar fenilalanin sitozol içinde gelen vardır. Hücre duvarı ihraç edilmekte, monolignols okside peroxidases veya laccases sonra onlar kimyasal radikal kaplin tepkiler lignin polimerler için polimerize geçmesi radikaller için bir işlemi olarak lignification. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Bioorthogonal reaksiyonlar kullanım için glycan analiz raporları çeşitli olmakla birlikte,2,3,17 biomolecules diğer türleri için kendi uygulama örnekleri daha az. Bioorthogonal kimya lignin bioimaging amaçlar için kullanımı ancak son zamanlarda Tobimatsu ve ark. tarafından öncülük 8 ‘ Arabidopsis thaliana nereye G birimleri, böylece kavram kanıtı gösteren8,9 formları lignin polimer alkol vekilleri coniferyl birleşme hakkında bilgi sağlamak için bu kimyasal muhabir stratejileri bu bağlamda geçerlidir. CuAAC kullanımı da farklı coniferyl alkol türev kullanarak bir kaç ay sonra Bukowski ve arktarafından betimlenir. 9 lignin ancak, ayrıca H ve S birimleri içerir ve lignification işlemi daha derin bir anlayış nasıl tüm monolignols polimer dahil edilmiştir hakkında daha fazla bilgi gerektirir ve ne faktörler kompozisyonunu kontrol edebilirsiniz. Bu alandaki yeni gelişmeler şu anda birden fazla kimyasal gazetecilere aynı anda yaşayan sistemler içinde izlemek için etkili yöntemler geliştirilmesi bağlıdır. Glukanlardir üzerinde bir kaç makale son yıllarda18,19‘,zemin koydu olsa bile20,21,22, yaklaşımlar etiketleme çift kalır içinde büyük bir meydan okuma bioorthogonal Kimya. Bir tekrarlanabilir tek etiketleme tıklayın Protokolü geliştirmek zor, o zaman çift karşılıklı iki tandem optimizasyonu gerektirir yaklaşımlar etiketleme ise iki ayrı kimyasal gazetecilere uyumlu bioorthogonal reaksiyonlar daha da zor. Bu yönü öncülük birkaç örnekler zorlanma terfi azid-ALKİN cycloaddition (SPAAC) ve alkene-tetrazine ters elektronik talep Diels-Alder (DAInv) reaksiyonları glukanlardir hayvan hücrelerinde çalışırdım. Ancak, biz DAinv tepki bioorthogonality (oluşan elektron-fakirlerle tepki verebilir yerine konan cinnamyl türü-elektron zengini monomerleri lignin ve yapısal özellikleri sayesinde bu uygulamada garanti değil olduğunu düşündüm Hava Dienes DAinv tepkileri kullanılan tetrazine sondalar gibi) ve bu belirsiz etiketleme oluşturabilir. Ayrıca, erişim, hem de için hantal ve böylece olasılığını yükseltmek lipofilik sentetik zor olan kimyasal kolları DAInv tepki gerektirir bu birleşme, taşıma ve/veya kimyasal yerelleştirilmesini oranı muhabir vivo içinde etkilenip etkilenmedikleri sınanmamıştır. Biz ikinci yönü özellikle lignification çalışmak için bir tıklama kimya yaklaşım söz konusu olduğunda ilgili olarak kabul olarak, farklı yönde seçti ve bir Bioorthogonal tüp ligasyonu Imaging sıralı strateji (mutluluk) kullanılarak geliştirilmiş bir Strain-Promoted azid ALKİN Cycloaddition (SPAAC) ve bakır katalizörlük azid ALKİN Cycloaddition (CuAAC) içinde vivo. 23
Bu iki tepkiler gerçekten iki ana bioorthogonal’ı tıklatın bugüne kadar kullanılan reaksiyonlar ve lignin ve birkaç örnek daha özellikle bu Imaging Yayınlandı son zamanlarda vardır. 8 , 9 çift etiketleme stratejimiz sağlar bir azid yan bir monolignol muhabiri ve terminal ALKİN diğer i) biyolojik ilgili yapıların doğru tepkisizdir ve II) çok küçük boyutlu (Şekil 2 iki kimyasal işleme ). Sonuç olarak, sentetik modifikasyonlardan altında eğitim biomolecule fizikokimyasal özellikleri üzerinde etkisi böylece taşıma açısından doğal olmayan ve doğal monolignol yüzeyler arasındaki olası tutarsızlıkları azaltmak küçültülür ve metabolization gore metabolik birleşme adım sırasında. SPAAC ve CuAAC ile birlikte ilk bakışta çok sezgisel görünüyor, bizim bilgi yapıları glukanlardir dışında bu strateji ve ilk uygulamasını kullanarak ikili işaretleme sadece ikinci örneği olsa da. 12 , 23
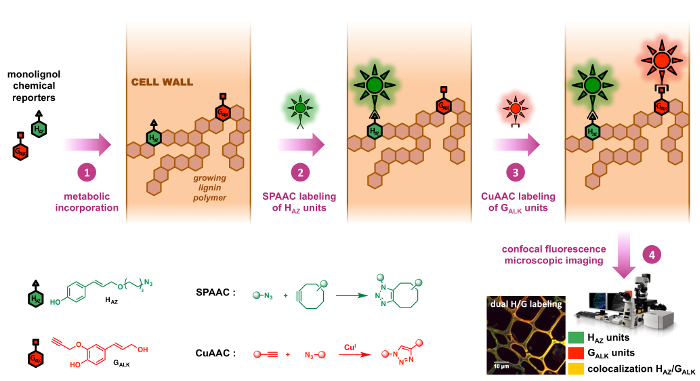
Şekil 2: BLISS strateji etiketleme ikili. Kimyasal gazetecilere HAZ ve GALK yerel H ve G monolignols tagged analogları vardır. Onlar ilk eksojen (Adım 1) besleme tarafından hücre duvarları büyüyen lignin polimerler dahil edilmiştir. Cyclooctyne – ve azid-floresan problar o zaman sırayla bakmaksızın anonim gazetecilere bioorthogonal tarafından functionalized kimya tıklatın: SPAAC reaksiyon (Adım 2) HAZ birimlerinin çok özel ve bir CuAAC reaksiyon (tarafından takip edilir 3. adım) GALK birimleri (Adım 3), belirli böylece her iki gazeteci belirli yerelleştirme izin bağımsız olarak aynı örnek. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Biz öncelikle tasarlanmış ve azid öğesini monolignol muhabir HAZ (vekil p– coumaryl alkol) ve lignin H birimleri habercisi doğrulanmış ve BLISS çift etiketleme stratejisi içinde kullanılan ile tandem tasarladı daha önce ALKİN öğesini GALK,9 (vekil coniferyl alkol) ve lignin G birimleri habercisi bildirdi. Geliştirilen ve keten içinde test tekrarlanabilir bu protokol için bir ekonomik açıdan önemli bitki türleri, HAZ ve GALK çift metabolik birleşme lignin içine ilk sıralı SPAAC/CuAAC önce elde edilir etiketleme. Burada, tagged HAZ birimleri ilk özellikle yolu ile etiketlenmiş GALK CuAAC-aracılı ligasyonu ikinci bir floresan inceleyebilirsek tarafından takip bir cyclooctyne functionalized fluorophore SPAAC ligasyonu etiketlenir birimleri. Bu yöntem lignification süreçleri bitki hücre duvarları içinde dinamikleri araştırmak için kullanılan ve kesitler, fidan farklı bitki türlerinin yanı sıra kaynaklanıyor yaşayan durdurması için uygulanan vivo içinde olabilir.
Protocol
Representative Results
Discussion
Daha önce belirtildiği gibi bu raporda sunulan çift etiketleme BLISS bir SPAAC/CuAAC kombinasyon vivo içinde12,23ilk örneklerinden biri protokoldür. Her adım iyice optimize edilmiş ve onaylanmış ve içinde iki etiketleme reaksiyonlar sırayla gerçekleştirilen kimya tıklatın sipariş saygı çok önemlidir (yani, SPAAC ilk, takip CuAAC tarafından). Tüm çapraz denetimleri BLISS Protokolü uygulanan23 olduğunda etiketleme her adım belirli olduğunu gösterdi: SPAAC adım taşıyan ilk yüksek chemoselective yol HAZ azid işlevleri tarafından etiketlerine göre cyclooctyne functionalized fluorophore hızlı kinetiği ile [3 + 2] cycloaddition reaksiyonu yoluyla. HAZ birimleri etiketlendikten sonra triazole bağlantılar tarafından tepki ile azid fluor 545 probe oluşturmak için GALK terminal alkynes aktivasyonu katalize copper(I) gerektiren CuAAC adım yapılabilir. Buna karşılık, ters sırada (yani, CuAAC ilk, takip SPAAC tarafından) GALK ve HAZ birimine yol açar gibi kullanılmamalıdır fluorophore ligasyonu ile birlikte buz dansında yarışmaktadır ve dramatik bir sinyal kaybı indükler çapraz-bağlantı . Non-spesifik boyama önlemek için ara çamaşır adımlar gerekliliğini vurgulamak önemlidir.
Biz bizim yöntem çeşitli biyolojik deney tasarımları için uygulanabilir olduğunu göstermiştir. İletişim kuralı etiketleme BLISS ilk serbest kesit önceden kesilmiş ve tıklayın hazır monolignols ile inkübe keten kaynaklanıyor (yaklaşık 150-250 µm kalınlığında) uygulandı. Bu tasarım gibi (kuluçka birimleri azaltılır) kimyasal muhabir gerekli miktarda en aza indirilmesi ve istatistiksel çoğaltır üretimini kolaylaştırmak avantajı olmasına rağmen bu kesinlikle bahsetmişken, bir vivo içinde sistem değil ve bazı durumlarda, değil gerçek spatio-temporal lignification dynamics tüm yönleriyle yansıtabilir. Bir ikinci deneysel tasarım, bu nedenle daha önce çam ve gingko27‘ deki radiolabeled monolignols birleşmesiyle çalışmak için kullanılan bir yöntem BLISS protokole uyarlanmış. Bu yaklaşımda, kökler ve kök bitki fiziksel olarak ayrılır ve tüm kök tabanı ne ‘çiçek vazo’ yaklaşım lakaplı içinde monolignol çözümünde inkübe. Sapları istediğiniz (kuluçka) zaman ayrıldıktan sonra kesit kesim ve gerçekleştirilen BLISS Protokolü vardır. Bu değiştirilmiş monolignols yaşayan kök taşınır ve lignin polimerler hücre duvarları içinde büyüyen dahil edilmiştir (i) olduğunu ve yerelleştirme modeli esas kesit için özdeş (II) olduğunu göstermek bize izin yaklaşım. Bu tür bir deney bir gerçek yaşam tesisinde gerçekleştirilen hak vardır / canlı hücre uzun deneyler ve daha ayrıntılı çalışmalar izin yaklaşım, ama kimyasal muhabir büyük miktarda gerektirir. Son olarak, BLISS protokolü de Keten bitki Fidan, bir gerçek yaşam içinde kimyasal gazetecilere kadar kök nakli önce kökleri absorbe olması gerekir bitki modeli temsil eden ile kullanıldı. Bu model uygulamada, yaşam tesislerinde gerçekleştirilen açık avantajı ise genç fidan sınırlıdır ve lignification dynamics büyük tesislerinde pratik nedenlerle (uzun bir kuluçka süresi, yükseltilmiş soruşturma için gerçekten uygun değildir ««kimyasal gazetecilere miktarı). Yine de, bu üç deney tasarımları tamamlayıcı niteliktedir ve tüm kendi artıları ve eksileri ile ilgili pratik yönleri ve biyolojik soru cevap türüne bağlı olarak biyolojik önemi var.
Keten lignification dinamiklerini incelemek için geliştirilen, bizim protokol son derece uyarlanabilir, sadece biyolojik deney tasarımı açısından aynı zamanda diğer uygulama açısından bitki tür ve organ/doku. Örneğin, BLISS kolayca Arabidopsis ya da daha fazla çalışmalar çeşitli genler için knock-out veya knock-down mutantlar ile mükellef bulunmaktadır Populus cins için transfer edilebilir. Prensip olarak, bizim yaklaşım ile çift etiketleme çalışmaları da diğer biomolecules için bitki hücre duvarı polimerler – tüm üç ana monolignols veya metabolik onların öncüleri olarak çeşitli de dahil olmak üzere iki ayrı değiştirilmiş öncüleri kullanarak uzatılabilir polisakkarit matris oluşturan bol. Kuruluşundan bu yana, bioorthogonal kimya gerçekten de esas olarak glukanlardir/polisakkaritler metabolik oligosakkarit mühendislik (MOE)4,5,17,28üzerinden araştırmak için geliştirilmiştir, Ama şaşırtıcı olmuştur sadece biyoloji bitki için çok az uygulamaları defa7,8,9,10,11,12. Tepkiler uyumluluk açısından, lignin ve çalışma gerçekten her iki kimyasal gazetecilere aynı retiküle polimer dahil edilmiştir gibi çözmek için karışık bir vaka oldu. Etiketlenmemiş HAZ– olasılığıGALK kullandığında oluşumu GALK ve HAZ birimleri 3D içinde kayma yakınlığı nedeniyle üstesinden gelmek için büyük bir sorun oldu. lignin23, iki kimyasal gazetecilere değil dahil edilmiştir Eğer biyopolimer aynı tür veya verilen herhangi bir hücreyi aynı kayma bölgesi olmayabilir bir sınırlama yapısını.
Daha geniş bir kapsamda BLISS metodoloji aslında iki farklı kimyasal gazetecilere taşıyan bir azid ve terminal ALKİN etiketi, sırasıyla kullanarak bakteriyel veya hayvan modellerinde herhangi bir iki renkli floresan görüntüleme çalışma için uygulanabilir.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Biz araştırma Federasyon FRABio ve TisBio görüntüleme platformu için borçlu bulunmaktadır (Univ. Lille, CNRS, FR 3688, FRABio, BiochimieStructurale et Fonctionnelle des buluntu Biomoléculaires) bu ulaşmak için elverişli teknik ortamı sağlamak için iş.
Materials
| (E)-4-(3-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)prop-1-en-1-yl)phenol (HAZ) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| (E)-4-hydroxy-3-propargyloxycinnamyl alcohol (GALK) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| 2% sodium hypochlorite | |||
| 20 cm high glass tube | |||
| 250 mL Schott glass bottle | |||
| 48-well Plate | |||
| 5/6-TAMRA-PEG3-Azide | Jena Bioscience | CLK-AZ109-1 | |
| Aluminium foil | |||
| Cheese cloth | |||
| Compost containing clay | |||
| Coniferyl alcohol (G) | Sigma Aldrich | MFCD00002922 | |
| Copper (II) sulfate pentahydrate | |||
| DBCO-PEG4-5/6-Carboxyrhodamine 110 | Jena Bioscience | CLK-A127-1 | |
| Milli-Q Ultrapure water | |||
| Eppendorf 1,5 mL | |||
| EtOH | |||
| Flax seeds (L. usitatissimum L.) | |||
| Fluoromount-G™ Slide Mounting Medium | Electron Microscopy Sciences | 17984-25 | |
| Glass coverslip | |||
| Glass microscope slide | |||
| Growth chamber | CLF-Plant Climatics | For 2-week-old plants culture | |
| Growth chamber | Angelantoni Life Sciences | For 2-month-old plants culture | |
| Magenta plant culture box | For 2-week-old seedling culture | ||
| Methanol | Toxic (SGH02, SGH06, SGH08), work with gloves under a hood | ||
| Micropipette | |||
| Nail polish | |||
| Nikon A1R confocal microscope | Nikon | ||
| Orbital shaker | |||
| Parafilm | |||
| p-Coumaryl alcohol (H) | Carbosynth | FC145653 | |
| Plastic cap | |||
| Plastic pipette | |||
| Plastic pot | For 2-month-old plants culture | ||
| Razor blade | |||
| Rubber band | |||
| Sodium Ascorbate | |||
| Sterile clamp | |||
| Vertical support | |||
| Vortex | |||
| Reagents for liquid and solid ½ MS medium | |||
| KH2PO4 | |||
| KNO3 | |||
| NH4NO3 | |||
| MgSO4.7H2O | |||
| CaCl2.2H2O | |||
| MnSO4.H2O | |||
| ZnSO4.7H2O | |||
| H3BO3 | |||
| KI | |||
| Na2MoO4.2H2O | |||
| CuSO4.5H2O | |||
| CoCl2.6H2O | |||
| Na2EDTA.2H2O | |||
| FeSO4.7H2O | |||
| Thiamine.HCl | |||
| Pyridoxine.HCl | |||
| Glycine | |||
| Nicotinic acid | |||
| Myo-inositol | |||
| Saccharose | |||
| MES hydrate | |||
| Agar |
Riferimenti
- Grammel, M., Hang, H. C. Chemical reporters for biological discovery. Nat Chem Biol. 9 (8), 475-484 (2013).
- Prescher, J. A., Bertozzi, C. R. Chemistry in living systems. Nat Chem Biol. 1 (1), 13-21 (2005).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality. Ange Chemie (Int Ed. Engl). 48 (38), 6974-6998 (2009).
- Chang, P. V., et al. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Ange Chemie (Int Ed. Engl). 48 (22), 4030-4033 (2009).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem. Commun. 52 (11), 2318-2321 (2016).
- Mbua, N. E., et al. Abnormal accumulation and recycling of glycoproteins visualized in Niemann-Pick type C cells using the chemical reporter strategy. Proc Natl Acad Sci U S A. 110 (25), 10207-10212 (2013).
- Anderson, C. T., Wallace, I. S., Somerville, C. R. Metabolic click-labeling with a fucose analog reveals pectin delivery, architecture, and dynamics in Arabidopsis cell walls. Proc Natl Acad Sci U S A. 109 (4), 1329-1334 (2012).
- Tobimatsu, Y., et al. A click chemistry strategy for visualization of plant cell wall lignification. Chem. Commun. 50 (82), 12262-12265 (2014).
- Bukowski, N., et al. Development of a clickable designer monolignol for interrogation of lignification in plant cell walls. Bioconjugate Chem. 25 (12), 2189-2196 (2014).
- Pandey, J. L., et al. A versatile click-compatible monolignol probe to study lignin deposition in plant cell walls. PLOS ONE. 10 (4), e0121334 (2015).
- Pandey, J. L., et al. Investigating biochemical and developmental dependencies of lignification with a click-compatible monolignol analog in Arabidopsis thaliana stems. Front Plant Sci. 7, (2016).
- Zhu, Y., Wu, J., Chen, X. Metabolic labeling and imaging of N-linked glycans in Arabidopsis thaliana. Ange Chemie (Int Ed. Engl). 55 (32), 9301-9305 (2016).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annu Rev Plant Biol. 54, 519-546 (2003).
- Weng, J. -. K., Chapple, C. The origin and evolution of lignin biosynthesis. New Phytol. 187 (2), 273-285 (2010).
- Mottiar, Y., Vanholme, R., Boerjan, W., Ralph, J., Mansfield, S. D. Designer lignins: harnessing the plasticity of lignification. Curr Opin Biotechnol. 37, 190-200 (2016).
- Rinaldi, R., et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis. Ange Chemie (Int Ed). 55 (29), 8164-8215 (2016).
- Wratil, P. R., Horstkorte, R., Reutter, W. Metabolic glycoengineering with N-acyl side chain modified mannosamines. Ange Chemie (Int Ed. Engl). 55 (33), 9482-9512 (2016).
- Feng, L., et al. Bifunctional unnatural sialic acids for dual metabolic labeling of cell-surface sialylated glycans. J Am Chem Soc. 135 (25), 9244-9247 (2013).
- Dumont, M., et al. Plant cell wall imaging by metabolic click-mediated labelling of rhamnogalacturonan II using azido 3-deoxy- d – manno -oct-2-ulosonic acid. Plant J. 85 (3), 437-447 (2016).
- Niederwieser, A., et al. Two-color glycan labeling of live cells by a combination of Diels-Alder and click chemistry. Ange Chemie Int Ed. 52 (15), 4265-4268 (2013).
- Späte, A. -. K., et al. Exploring the potential of norbornene-modified mannosamine derivatives for metabolic glycoengineering. Chem Bio Chem. 17 (14), 1374-1383 (2016).
- Späte, A. -. K., et al. Rapid Labeling of metabolically engineered cell-surface glycoconjugates with a carbamate-linked cyclopropene reporter. Bioconjugate Chem. 25 (1), 147-154 (2014).
- Lion, C., et al. BLISS: a bioorthogonal dual-labeling strategy to unravel lignification dynamics in plants. Cell Chem Biol. 24 (3), 326-338 (2017).
- del Río, J. C., et al. Structural characterization of guaiacyl-rich lignins in flax (Linum usitatissimum) fibers and shives. J Agric Food Chemist. 59 (20), 11088-11099 (2011).
- Huis, R., et al. Natural hypolignification is associated with extensive oligolignol accumulation in flax stems. Plant Physiol. 158 (4), 1893-1915 (2012).
- Chantreau, M., et al. Ectopic lignification in the flax lignified bast fiber1 mutant stem is associated with tissue-specific modifications in gene expression and cell wall composition. The Plant Cell. 26 (11), 4462-4482 (2014).
- Terashima, N., Ko, C., Matsushita, Y., Westermark, U. Monolignol glucosides as intermediate compounds in lignin biosynthesis. Revisiting the cell wall lignification and new 13C-tracer experiments with Ginkgo biloba and Magnolia liliiflora. Holzforschung. 70 (9), 801-810 (2016).
- Noel, M., et al. Probing the CMP-sialic acid donor specificity of two human β-d-galactoside sialyltransferases (ST3Gal I and ST6Gal I) selectively acting on O- and N-glycosylproteins. Chembiochem: Eur J Chem Biol. , (2017).

